
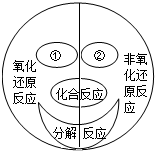
 广义的氧化还原反应是指:在反应前后有元素化合价发生变化的化学反应都属于氧化还原反应.如图是小明构建的四种基本反应类型与氧化还原反应的关系图.根据此图回答下列问题:
广义的氧化还原反应是指:在反应前后有元素化合价发生变化的化学反应都属于氧化还原反应.如图是小明构建的四种基本反应类型与氧化还原反应的关系图.根据此图回答下列问题:分析 (1)分析②所处的位置可知它是属于非氧化还原反应中的一种基本反应类型,依据题干中关于氧化还原反应的说明对除化合和分解反应以外的两种基本反应进行分析判断即可;
(2)根据分解反应又是氧化还原反应的含义,据此书写即可.
解答 解:(1)分析②所处的位置可知它是属于非氧化还原反应中的一种基本反应类型,因为氧化还原反应在反应前后有元素化合价发生变化,所以考虑基本反应类型中的复分解反应,因为复分解是两种化合物交换成分生成另外的两种化合物,所以一定镁有化合价变化,所以②代表的基本反应类型是复分解反应,则②应该是复分解反应;故填:复分解反应;
(2)过氧化氢分解生成水和氧气,是一种物质反应生成两种物质,且有化合价的改变,所以既是分解反应,也是氧化还原反应.故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
点评 本题主要考查了基本反应类型与氧化还原反应的关系,掌握化合反应、分解反应、置换反应、复分解反应的特点及其应用是解题的关键.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中 取样于试管中 滴加稀盐酸(或氯化钡溶液) | 产生气泡 (或产生白色沉淀) | 猜想②正确 相关的化学方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑ Na2CO3+BaCl2=BaCO3↓+2NaCl |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 一定有硫酸铜 | B. | 可能有氢氧化钠 | C. | 一定有碳酸钠 | D. | 可能有碳酸钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 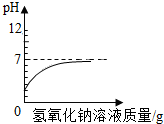 向pH=2的盐酸中滴加过量的氢氧化钠溶液 | |
| B. | 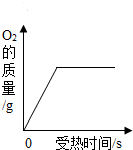 用适量的KClO3和MnO2混合物加热制O2 | |
| C. | 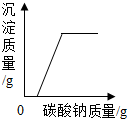 向一定量的稀盐酸和氯化钙的混合液中不断滴入碳酸钠溶液至过量 | |
| D. | 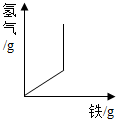 向一定质量的稀盐酸中加入铁粉至过量 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用pH试纸测定溶液的酸碱度,需先将试纸用水润湿 | |
| B. | 配制一定质量分数的氯化钠溶液,所用烧杯需要干燥 | |
| C. | 做铁丝与硫酸铜溶液反应实验,铁丝需要用砂纸打磨 | |
| D. | 进行过滤操作,需先将滤纸折成圆锥形后放在漏斗中润湿使之紧贴漏斗内壁 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
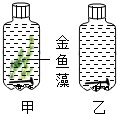 如图所示,玻璃瓶中都装满冷开水,并加入碳酸氢钠(一种二氧化碳释放剂).将装置置于光照条件下,一段时间后,判断甲、乙两瓶中哪枚铁钉先出现锈迹,并说明理由.
如图所示,玻璃瓶中都装满冷开水,并加入碳酸氢钠(一种二氧化碳释放剂).将装置置于光照条件下,一段时间后,判断甲、乙两瓶中哪枚铁钉先出现锈迹,并说明理由.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 减少食物加工过程 | B. | 注意节约用电 | ||
| C. | 尽量购买本地的、当季的食物 | D. | 大量使用化肥和农药 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
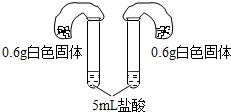 碳酸钠和碳酸氢钠是生活中常见的两种白色固体,同学们对鉴别这两种物质非常感兴趣,进行如下探究.
碳酸钠和碳酸氢钠是生活中常见的两种白色固体,同学们对鉴别这两种物质非常感兴趣,进行如下探究.| 10℃ | 20℃ | 30℃ | 40℃ | |
| Na2CO3 | 12.5 g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.lg | 12.7g |
| 性质 | Na2CO3 | NaHCO3 | 性质比较 |
| 溶液的酸碱性 | 碱性 | 碱性 | 相同条件下,Na2C03溶液的碱性更强 |
| 热稳定性 | 稳定 | 不稳定 | NaHCO3受热分解生成Na2C03、C02 和H20 |
| 与盐酸反应 | 反应 | 反应 | 均产生CO2,但NaHCO3与盐酸的反应更加剧烈 |
| 实验方案 | 实验现象及结论 1 |
| 方案一:20℃时,在100g水中加入11g该白色固体,充分溶解 | 若有白色固体剩余,样品为碳酸氢钠; 否则为碳酸钠. |
| 方案二:分别将两种白色固体溶于水制成5%的溶液,用玻璃棒分别蘸取少量待测液于pH试纸上,将其与标准比色板对照. | pH值小的为碳酸氢钠溶液. |
| 方案三:分却取少量固体于試管中加热,然后将产生的气体通入石灰水中. | 能产生使石灰水变浑浊的气体的是碳酸氢钠. |
| 方案四:如图所示,分别将气球中的固体粉末全部且同时倒入装有过量盐酸的试管中,观察现象. | 1.试管中剧烈反应,反应更加剧烈的是碳酸氢钠; 2.反应后两气球鼓起,鼓起较大的是碳酸氢钠. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com