
【题目】a、b、c 三种固体物质(均不含结晶水)的溶解度曲线如图所示。
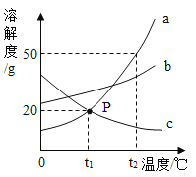
(1)P 点的含义是:_________________。
(2)t2℃时,把50g a 放入 50 g 水中,充分搅拌,所得溶液的质量是___________。
(3)若从 a 的饱和溶液中析出晶体 a,常用的结晶方法是_____________。
(4)t2℃时 a、b、c 三种物质的饱和溶液各 100g,分别降温到t1℃时,所得溶液中溶剂的质量由大到小顺序排列依次为______________。
【答案】t1℃时,a、c物质的溶解度相等,且溶解度都为20g 75g 降温结晶 c>b>a
【解析】
(1)通过分析溶解度曲线可知,P点的含义是: t1℃时,a、c物质的溶解度相等,且溶解度都为20g;是1234
(2) t2℃时,a物质的溶解度是50g,所以把50g a放入50g水中,充分搅拌,只能溶解25g的固体,所以所得溶液的质量是75g;
(3) a物质的溶解度受温度变化影响较大,所以若从a的饱和溶液中析出晶体a,常用的结晶方法是降温结晶;
(4) t2℃时,a物质的溶解度最大,c物质的溶解度最小,a、b、c三种物质的饱和溶液各100g,a中的溶剂最少,c中的溶剂最多,分别降温到t1℃时,不会影响溶剂的质量变化,所得溶液中溶剂的质量由大到小顺序排列依次为: c>b>a。


科目:初中化学 来源: 题型:
【题目】向盛有10mL NaOH溶液(其中滴有少量无色酚酞溶液)的烧杯中逐滴加入稀盐酸,用pH计(用来精确测定溶液pH的仪器)测定溶液的pH,所得数据如下:
加入稀盐酸的体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
烧杯中溶液的pH | 12.9 | 12.7 | 12.5 | 12.3 | 11.9 | 7.0 | 2.1 | 1.9 |
(1)当加入稀盐酸的体积为___________ mL时,NaOH溶液和稀盐酸恰好完全反应,反应的化学方程式为_____________。
(2)当加入稀盐酸的体积为3mL时,溶液显________色;
(3)当烧杯中溶液的pH=2.1时,溶液中的溶质有:__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】正确选择实验仪器是实验成功的重要保证。下面是实验室中常见的仪器,请按要求填空:

(1)实验室配制50g15%的氯化钠溶液的步骤有:计算、____、量取水、溶解、装瓶。溶解过程中,需用到上图仪器中的E和___(填序号),E作用是____。下列操作中,可能导致配制溶液质量分数偏大的是__。
a 秤取时将氯化钠置于托盘天平的右盘 b 量取水时俯视读数
c 用已有少量水的烧杯溶解氯化钠 d 转移时有少量溶液溅出
(2)用高锰酸钾受热分解制氧气的化学方程式为____,实验室组装该反应发生装置,需要的仪器有____(填序号)。
(3)组合仪器C与F:当瓶中装满水时,可收集氢气,气体应从仪器F的____(填“a”或“b”)端通入;若利用该装置干燥二氧化碳,瓶中应盛放试剂是____;检验二氧化碳反应的化学方程式是____。
(4)现有一份氧元素质量分数为90% 的过氧化氢溶液,加入MnO2充分反应后,得到液体的质量为 90g(不考虑过程中液体的损失)),则生成氧气的质量为____g.。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】胃酸过多须服用抗酸药物(能与盐酸反应),常用的抗酸药物有碳酸氢钠片、铝碳酸镁片,兴趣小组的同学对这两种药物开展如下探究。
(查阅资料)①铝碳酸镁片的主要成分的化学式为AlMg(OH)3CO3;
②抗酸原理:抗酸药物中的离子和胃酸中的氢离子反应,降低胃液酸性。
活动一:定性探究抗酸药物与“胃酸”的反应。
(1)铝碳酸镁片中含有铝离子、镁离子、氢氧根离子和碳酸根离子。结合上述知识分析,该药物起抗酸作用的微粒是_____(填化学符号)。
(2)小王取一定量碳酸氢钠片与4mLpH═1的稀盐酸(模拟胃酸)反应。药片中其他成分不溶于水也不参加反应。他对反应后溶液的成分产生了兴趣。
(作出猜想)
猜想 1:只含 NaCl;
猜想 2:_____;
猜想 3:NaCl、NaHCO3
(设计实验)
实验步骤 | 实验现象 | 实验结论 | |
实验一 | 取一定量反应后的溶液于试管中,滴加_____ | 无明显现象 | 猜想 3错误 |
实验二 | 另取一定量反应后的溶液于试管中,______ | ______ | 猜想 2正确 |
实验二中涉及反应的化学方程式为______。
活动二:定量探究抗酸药物与“胃酸”的反应,对比分析产生 CO2的速率快慢和中和酸的能力强弱。
如图 1,利用数字化实验分别测定碳酸氢钠片、铝碳酸镁片与“胃酸”反应时,产生 CO2的速率快慢和 pH的变化,得到“二氧化碳浓度与时间”曲线(如图 2)、“pH与时间”曲线(如图 3)。
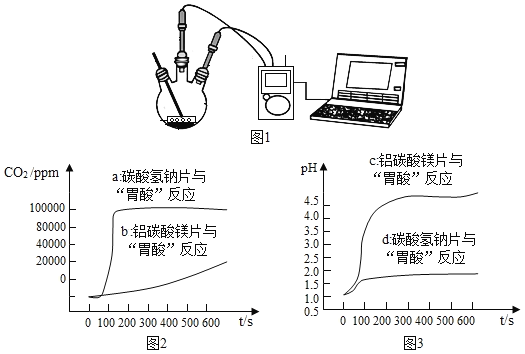
(1)服用碳酸氢钠片更易造成胃胀气,原因是_____。
(2)铝碳酸镁片中和酸的能力更强,理由是_____。
(反思与提升)日常生活中,我们应该根据个人的具体病情,选择合适种类的胃药。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种重要的化工产品,能杀菌消毒,广泛用于果蔬保鲜、 空气净化、污水处理等方面。某兴趣小组同学对其进行了有关探宄。
(查阅资料)
(1)过氧化钙是白色、无毒、难溶于水的白色粉末。
(2)![]() 。
。
(3)![]() ;二氧化锰与稀盐酸不反应。
;二氧化锰与稀盐酸不反应。
(探宄1)验证过氧化钙受热分解的产物。
(1)取少量纯净的过氧化钙放入试管中充分加热,将带火星的木条伸入试管,可观察到带火星的木条_______。
(2)待(1)中试管冷却,取管中少量固体加水充分搅拌,静置,向上层清液中滴加几滴酚酞试液,可观察到溶液变成_________色。
(探宄2)测定产品中过氧化钙的质量分数(假设过氧化钙产品中只含有氧化钙杂质)。
(实验装置)
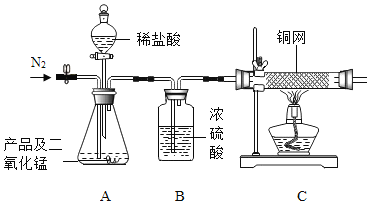
(实验步骤)
①连好装置并检查装置的气密性,在锥形瓶中放入4g该产品;②实验前称量C中铜网的质量;③先缓慢通入氮气,一段时间后加热铜网至红热;再缓慢滴入过量稀盐酸,直至A中样品完全反应;④继续缓慢通入氮气,一段时间后停止加热,待C中铜网冷却后,停止 通入氮气;⑤再次称量C中铜网的质量,发现比反应前増重0.8g。
(实验结论)
(1)A中二氧化锰的作用是____________________。
(2)C中铜网发生反应的化学方程式为______________。
(3)该产品中过氧化钙的质量分数为___________。
(拓展提升)若A中样品完全反应后,立即停止通氮气并熄灭酒精灯,待C中铜网冷却后称量其质量。你认为该操作对测定产品中过氧化钙的质量分数是否有影响?_____________。(选填“是”或“否”,并说明理由)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】酱油是一种常用调味剂,酱油中 NaCl 的质量分数要求不能低于 15%。向某市售酱油中逐滴加入溶质质量分数为 17%的硝酸银溶液至无沉淀产生时,消耗硝酸银溶液200g,过滤后,称量反应后溶液总质量271.3g。请计算:
(1)氯化钠中钠元素与氯元素的质量比 (化为整数比)。
(2)该市售酱油中氯化钠的质量分数。
(3)该市售酱油是否符合 NaCl 含量要求 (填“符合”或“不符合”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】乙醇(C2H6O)在一定量的氧气中不完全燃烧时可以产生二氧化碳、水和物质X。
物质 | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 58 | 89.6 | 0 | 15 | 0 |
反应后质量/g | 12 | 0 | 70.4 | 69 | a |
(1)根据表中数据分析,a的值为______
(2)X的化学式为____
(3)写出本题中乙醇燃烧的化学方程式:________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列关于化学反应类型的说法正确的
A. 凡是生成盐和水的反应都是中和反应
B. 复分解反应一定没有单质参加
C. 生成一种单质和一种化合物的反应一定是置换反应
D. 分解反应的生成物一定有单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com