
| 80 |
| 0?8g |
| 106 |
| x |
| 80 |
| 0?8g |
| 168 |
| y |
| 80 |
| a |
| 106 |
| b |
| 80 |
| 0?8g-a |
| 168 |
| 1?37g-b |
| 12 |
| 44 |
| 12 |
| 106 |
| 12 |
| 84 |


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
| ||
| 4.4×8.8g |
| 100 |
| 4.4×8.8g |
| 100 |
| 8.8g |
| 10g |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
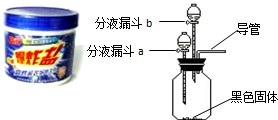 去的多种顽固污渍”.小强同学对这种“污渍爆炸盐”的化学成分非常感兴趣,对其化学成分进行探究.主要探究过程如下:
去的多种顽固污渍”.小强同学对这种“污渍爆炸盐”的化学成分非常感兴趣,对其化学成分进行探究.主要探究过程如下:| 序号 | 主要操作步骤 | 主要实验现象 | 操作目的 |
| ① | 在广口瓶中加入少量 二氧化锰 二氧化锰 (黑色固体);在分液漏斗a中加入新配制的“污渍爆炸盐”的饱和水溶液;在分液漏斗b中加入稀盐酸 稀盐酸 . |
无 无 |
检验溶液中是否含有过氧化氢 检验溶液中是否含有过氧化氢 |
| ② | 打开分液漏斗a的活塞,放出适量溶液后,关闭活塞. | 生成大量无色气体. | 检验过氧化氢分解 检验过氧化氢分解 |
| 然后 用带火星的木条接近导管口 用带火星的木条接近导管口 . |
带火星的木条复燃 带火星的木条复燃 |
验证生成气体的成分 | |
| 第②步操作得到的结论:“污渍爆炸盐”溶于水生成过氧化氢. | |||
| ③ | 待②步反应停止后,打开分液漏斗b的活塞,放出适量溶液后,关闭活塞. | 生成大量无色气体. | 检验碳酸钠和盐酸反应 检验碳酸钠和盐酸反应 |
| 将生成的气体通入 澄清石灰水 澄清石灰水 . |
澄清石灰水变浑浊 澄清石灰水变浑浊 . |
验证生成气体的成分 | |
| 第③步操作得到的结论:“污渍爆炸盐”溶于水生成碳酸钠. | |||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 序号 | 实验内容 | 实验现象 | 实验结论 |
| ① | 取少量样品于烧杯中,滴加稀盐酸 | 有大量气泡生成 | 本格不填 |
| ② | 用铂丝蘸取①中溶液,在酒精灯上灼烧 | 火焰为砖红色 | 溶液中含有钙离子 |
| ③ | 另取少量样品于烧杯中,加水充分溶解,滴加 碘水或碘酒 碘水或碘酒 |
无蓝色出现 | 样品中不含有淀粉 |
| ④ | 另取少量样品于烧杯中,加水溶解,静置、过滤,在滤液中加入适量浓硝酸,加热至沸 | 产生黄色固体 产生黄色固体 |
样品中含蛋白粉 (氨基酸) |
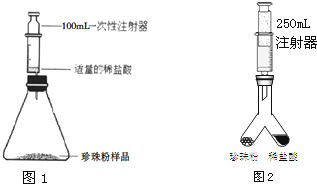
| 100 |
| x |
| 44 |
| 0.44g |
| 1g |
| 1.1g |
| 100 |
| x |
| 44 |
| 0.44g |
| 1g |
| 1.1g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com