解:(1)①由氮化镁中氮元素的化合价为-3价,镁元素的化合价为+2价,则
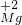
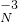
,化合价相互交叉可得化学式为Mg
3N
2,故答案为:Mg
3N
2;
②由镁在空气中燃烧还发生镁与二氧化碳反应生成碳单质和氧化镁,则反应为CO
2+2Mg

2MgO+C,故答案为:CO
2+2Mg

2MgO+C;
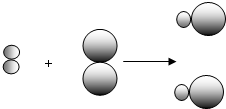
(2)①由不同的小球代表A元素的原子和B元素的原子,则反应物A
2、B
2都是由一种元素组成,而生成物由两种元素组成,则A
2、B
2都属于单质,故答案为:A
2、B
2;
②因同种元素具有相同的质子数,则同种元素的不同原子的质子数相同,故答案为:质子数(核电荷数);
③根据质量守恒定律可知,反应前后元素的种类、原子的种类和个数不变,参加反应的物质的质量之和等于
反应后生成物的质量之和,则a、b、d一定不变,在该反应A
2+B
2═2AB中,反应前后的分子数相等,反应前两种
分子,而反应后一种分子,则分子的种类变化,故c不选,故答案为:a、b、d;
(3)由反应前后的质量可知,B的质量不变,B可能为催化剂,而C的质量减少22g-14g=8g,D的质量增加24g-1g=23g,根据质量守恒可知,A应质量减少,其减少的质量为23g-8g=15g,即15g的A与8gB反应生成23gD,
则设A与C的化学计量系数分别为x、y,D的化学计量数为z,
即xA+yC

zD,A与C的相对分子质量之比为15:16,
则15x:16y=15g:8g,
解得x:y=2:1,
故答案为:2:1.
分析:(1)①根据元素的化合价来书写物质的化学式;
②根据反应物与生成物来书写化学反应方程式;
(2)①根据单质是由一种元素组成,则由一种原子构成的分子,其对应的物质属于单质;
②根据质子数决定元素的种类来分析同种元素;
③根据质量守恒定律来分析反应前后的变化;
(3)根据质量变化来分析反应物与生成物,再利用化学反应中参加反应的质量之比等于方程式中的相对分子质量之比(化学计量数与分子的相对分子质量的积)来解答.
点评:本题考查知识点较多,注重对化学用语的考查,学生熟悉元素的化合价、质量守恒定律、物质的分类等式解答本题的关键.

 表示A元素的原子,
表示A元素的原子, 表示B元素的原子.某反应前后的物质微观示意图如下.
表示B元素的原子.某反应前后的物质微观示意图如下.
 和
和 中的
中的 属于同种元素,这是因为这些原子含有相同的______.
属于同种元素,这是因为这些原子含有相同的______.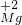
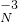 ,化合价相互交叉可得化学式为Mg3N2,故答案为:Mg3N2;
,化合价相互交叉可得化学式为Mg3N2,故答案为:Mg3N2; 2MgO+C,故答案为:CO2+2Mg
2MgO+C,故答案为:CO2+2Mg 2MgO+C;
2MgO+C; zD,A与C的相对分子质量之比为15:16,
zD,A与C的相对分子质量之比为15:16,

 阅读快车系列答案
阅读快车系列答案 --氢原子
--氢原子 --碳原子
--碳原子 --氧原子
--氧原子




 ”、“
”、“ ”、“
”、“ ”分别表示A、B、C三种物质的分子,下图表示某化学反应前后反应物与生成物分子及其数目的变化.该化学方程式中A、B、C前的化学计量数之比为
”分别表示A、B、C三种物质的分子,下图表示某化学反应前后反应物与生成物分子及其数目的变化.该化学方程式中A、B、C前的化学计量数之比为

 表示A元素的原子,
表示A元素的原子, 表示B元素的原子.某反应前后的物质微观示意图如下.
表示B元素的原子.某反应前后的物质微观示意图如下.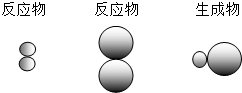
 和
和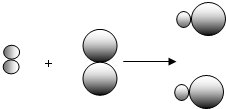 中的
中的 属于同种元素,这是因为这些原子含有相同的
属于同种元素,这是因为这些原子含有相同的 表示甲元素的原子,
表示甲元素的原子, 表示乙元素的原子.某反应前后的物质微观示意图如下.
表示乙元素的原子.某反应前后的物质微观示意图如下.


 和
和 中的
中的 属于同种元素,这是因为这些原子含有相同的
属于同种元素,这是因为这些原子含有相同的




