
| A. | 石油是一种常用的燃料 | B. | 石油是纯净物,煤是混合物 | ||
| C. | 石油中氢元素含量比煤高 | D. | 煤在空气中燃烧只产生CO2 |
分析 A.根据石油的分馏来分析;
B.根据物质的组成来分析;
C.根据石油和煤炭中的氢含量来分析;
D.根据煤炭的组成来分析.
解答 解:A.石油分馏出来的汽油、柴油等是常用的燃料,而不是直接用石油作燃料,故错误;
B.石油和煤都是由多种物质组成的混合物,故错误;
C.从组成上看,煤和石油都主要含有碳元素,煤和石油的最大区别是氢元素含量不同,煤中含氢元素5%~8%,石油中含氢元素11%~14%,故正确;
D.煤炭中除了主要含碳元素以外,还含有氢元素、氮元素、硫元素等,因为在空气中完全燃烧生成二氧化碳、水、氮氧化物、二氧化硫等,故错误.
故选C.
点评 解答本题的关键是要充分了解化石燃料方面的知识,只有这样才能对问题做出正确的判断.


科目:初中化学 来源: 题型:选择题
| A. | 粗盐提纯时,用玻璃棒搅拌可加快过滤的速度 | |
| B. | 蒸发滤液时,待蒸发皿中液体蒸干时停止加热 | |
| C. | 配制溶液时,仰视量筒读数,会导致配制的溶液偏稀 | |
| D. | 配制溶液时,必须使用的仪器有托盘天平、酒精灯、量筒、烧杯、玻璃棒等 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 溶解度 | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| 氢氧化钠 | 109 | 129 | 174 | 314 | 347 |
| 氯化钠 | 36.0 | 36.4 | 37 | 38.2 | 40 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
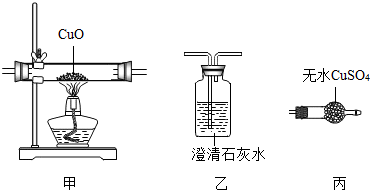
| A. | 甲、乙、丙 | B. | 丙、乙、甲 | C. | 丙、甲、乙、丙 | D. | 丙、甲、丙、乙 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
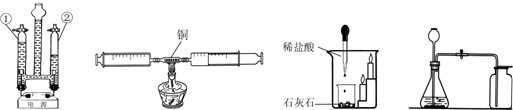
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25g | 100g | 200g | 300.4g |
| 加入稀盐酸的质量 | 100g | 200g | 300g | 400g |
| 充分反应后烧杯及杯内物质总质量 | 222.8g | 320.6g | 418.4g | 518.4g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  称量固体NaOH | B. | 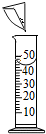 在量筒内配制食盐水 | ||
| C. | 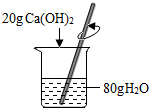 配制20%的Ca(OH)2溶液 | D. | 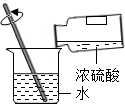 将浓H2SO4稀释成稀H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com