
 某活动小组的同学研究了一些常见金属的结构、性质、用途和变化规律等.
某活动小组的同学研究了一些常见金属的结构、性质、用途和变化规律等.| 实验步骤 | 现象 | 化学方程式 |
| 取少量固体样品,加稀盐酸 | 有无色气味气体生成 | Zn+2HCl=ZnCl2+H2↑ |
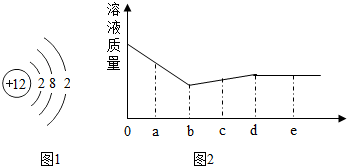
分析 (1)根据镁原子结构示意图和地壳中最多的元素进行分析;
(2)铝在空气中和氧气反应能够生成一层致密的氧化铝薄膜;铁在潮湿的空气中易生锈;
(3)金属活动性:锌>铜>银;相对原子质量:银>锌>铜;据此结合相关知识作答;
(4)根据化学方程式找出已知量和未知量进行计算.
解答 解:(1)A、原子结构示意图中圆圈内数字就是质子数;所以镁原子质子数是12,所以镁原子的核外电子数为12,故错误;
B、由于镁原子最外层电子数是2易失去2个电子,显+2价,故正确;
C、镁自空气中燃烧发出耀眼白光,故正确;
D、地壳中含量最多的金属元素是铝,故错误;
故答案为:AD;
(2)由于铝和氧气反应生成一层致密的氧化铝薄膜,对自身起到了保护作用,尽管铝的活动性比铁强,但铝制品比铁制品耐腐蚀;沿海地区比沙漠地区空气潮湿,铁在潮湿的空气中易生锈,所以相同铁制品在沿海地区比在沙漠地区生锈速度更快;
故答案为:铝和氧气反应生成一层致密的氧化铝薄膜,对自身起到了保护作用;沿海地区比沙漠地区空气潮湿,铁在潮湿的空气中易生锈;
(3)向一定量的硝酸银和硝酸铜的混合溶液中加入锌粉,ob段表示锌和硝酸银的反应,bd段表示锌和硝酸铜的反应,结合溶液质量与加入锌的质量关系图:①当锌的质量为ag时,溶液中还有部分硝酸银没有反应完,所以溶液中的溶质一定有硝酸锌、硝酸银、硝酸铜;②当锌的质量为bg时,溶液中含有硝酸铜,溶液呈蓝色;③当锌的质量为cg和dg时,锌已过量,锌把硝酸银、硝酸铜都反应完了,过滤后得到固体含有锌银铜,由于锌能与酸反应产生氢气,所以向固体中加入盐酸,有氢气产生;
故答案为:①Zn(NO3)2、AgNO3、Cu(NO3)2;②蓝;③
| 实验步骤 | 现象 | 有关反应的化学方程式 |
| 稀盐酸 | Zn+2HCl=ZnCl2+H2↑ |
点评 本题考查了金属活动性顺序的应用及根据化学方程式进行简单的计算,完成此题,可以依据金属活动性顺序及其意义进行分析,注意金属与盐溶液反应的顺序是最强的金属先和最弱的金属盐溶液反应.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
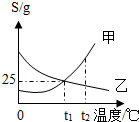 如图为甲、乙两种固体的溶解度曲线,下列说法正确的是( )
如图为甲、乙两种固体的溶解度曲线,下列说法正确的是( )| A. | 甲、乙溶解度均随温度升高而增大 | |
| B. | 降温或蒸发均可使乙物质从其饱和溶液中结晶析出 | |
| C. | 甲、乙饱和溶液从t1升温之t2时,其浓度均保持不变 | |
| D. | t1时,甲、乙饱和溶液中溶质和溶剂的质量比均为1:4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 化学是一门以实验为基础的科学,实验是学习化学的一条重要途径.根据以下实验解答下列问题:
化学是一门以实验为基础的科学,实验是学习化学的一条重要途径.根据以下实验解答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com