
| A. | 石墨(C) | B. | 干冰(CO2) | C. | 氯化钾(KCl) | D. | 苏打(Na2CO3) |
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质分类 | 金属单质 | 氧化物 | 稀有气体 |
| 化学式(各写一种) | Fe(或Al) | CO2 | Ar |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | “塑化剂”的相对分子质量为242 | |
| B. | “塑化剂”是化合物 | |
| C. | “塑化剂”由碳、氢、氧三种元素组成 | |
| D. | “塑化剂”中碳、氢、氧元素的质量比为12:34:4 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图所示,上瓶装的是无色的空气,下瓶装的是不与空气发生化学反应的某种红棕色气体,当抽走玻璃片后,过一会,将会发生的现象是红棕色气体逐渐向上瓶中扩散,下瓶颜色变浅,最后上下两瓶中气体的颜色一致,此实验可以说明分子是在不断运动的且分子间存在间隙.
如图所示,上瓶装的是无色的空气,下瓶装的是不与空气发生化学反应的某种红棕色气体,当抽走玻璃片后,过一会,将会发生的现象是红棕色气体逐渐向上瓶中扩散,下瓶颜色变浅,最后上下两瓶中气体的颜色一致,此实验可以说明分子是在不断运动的且分子间存在间隙.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

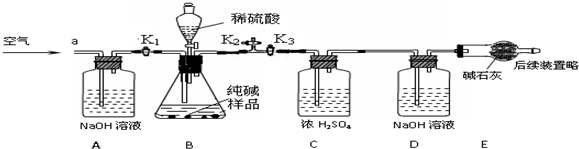
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com