
 如图所示,上瓶装的是无色的空气,下瓶装的是不与空气发生化学反应的某种红棕色气体,当抽走玻璃片后,过一会,将会发生的现象是红棕色气体逐渐向上瓶中扩散,下瓶颜色变浅,最后上下两瓶中气体的颜色一致,此实验可以说明分子是在不断运动的且分子间存在间隙.
如图所示,上瓶装的是无色的空气,下瓶装的是不与空气发生化学反应的某种红棕色气体,当抽走玻璃片后,过一会,将会发生的现象是红棕色气体逐渐向上瓶中扩散,下瓶颜色变浅,最后上下两瓶中气体的颜色一致,此实验可以说明分子是在不断运动的且分子间存在间隙. 分析 微观粒子的特征:质量和体积都很小;微粒与微粒之间有间隙;都是不断运动的.微粒运动的速率随着温度的升高而加快.
解答 解:因为二氧化氮的密度比空气大,所以短时间无法看到明显现象.当用酒精灯加热时,温度升高,分子的运动速率加快,会观察到显著的现象:红棕色气体逐渐向上瓶中扩散,下瓶颜色变浅,最后上下两瓶颜色一致,都是红棕色.
该实验说明了:分子是在不断运动的且分子间存在间隙.
故答案为:红棕色气体逐渐向上瓶中扩散,下瓶颜色变浅;一致;分子是在不断运动的且分子间存在间隙.
点评 解答本题的关键是要充分理解微观粒子总是在不断运动的,同时温度影响运动的速度.(不过这样的加热方式用来解释分子不断运动欠妥当,如同一旦用搅拌方式就不能很好说明分子运动本身的自发性一样).


 应用题作业本系列答案
应用题作业本系列答案科目:初中化学 来源: 题型:解答题
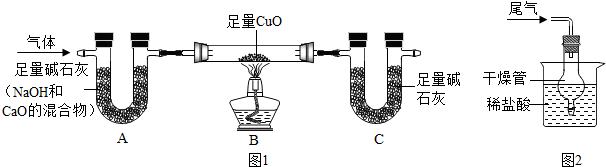
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | a=b≥2.4g | B. | a=b≥1.8g | C. | a=2.4g,b=1.8g | D. | a<2.4g,b<1.8g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 2CO:表示2个一氧化碳分子 | |
| B. | 2H:表示两个氢原子 | |
| C. | Fe2+中的“2”表示每个铁离子带两个单位的正电荷 | |
| D. | H2S中的“2”表示一个硫化氢分子中含有2个氢原子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | BaCl2 NaCl CaCl2 NaOH | B. | KNO3 NaCl AgNO3 Mg(NO3)2 | ||
| C. | CuSO4 KCl AgNO3 Na2SO4 | D. | BaCl2 CaCl2 KCl Al(NO3)3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
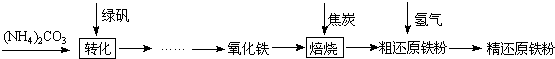

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com