
| A. | 干冰用于人工降雨 | B. | 金刚石用于切割玻璃 | ||
| C. | 铜用于制作导线 | D. | 稀有气体用作焊接保护气 |
分析 物质在化学变化中表现出来的性质叫化学性质,物质不需要发生化学变化就表现出来的性质,叫物理性质;物理性质经常表现为:颜色、状态、气味、密度、硬度、熔点、沸点、导电性、导热性、溶解性、挥发性等.干冰用于人工降雨是干冰吸热升华,属于物理性质;金刚石用于切割玻璃是利用金刚石的硬度,属于物理性质;铜用于制作导线是利用铜的导电性,属于物理性质;稀有气体用作焊接保护气是利用稀有气体的稳定性,属于化学性质.
解答 解:A、干冰用于人工降雨是干冰吸热升华,属于物理性质,故选项错误;
B、金刚石用于切割玻璃是利用金刚石的硬度,属于物理性质;故选项错误;
C、铜用于制作导线是利用铜的导电性,属于物理性质,故选项错误;
D、稀有气体用作焊接保护气是利用稀有气体的稳定性,属于化学性质,故选项正确;
故选D
点评 本考点考查了物理性质和化学性质的区分,要记忆有关干冰、金刚石、铜和稀有气体的性质,并能够在比较的基础上进行应用,本考点的基础性比较强,主要出现在选择题和填空题中.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:推断题
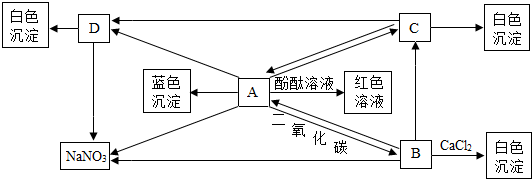
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 检验二氧化碳 | 将二氧化碳通入紫色石蕊溶液中 |
| B | 鉴别氮气和二氧化碳 | 将燃着木条伸入瓶中 |
| C | 除去硫酸亚铁溶液中的硫酸铜 | 加足量铁粉并过滤 |
| D | 除去粗盐中的难溶性杂质 | 将粗盐研碎、溶解、蒸发 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 55% | B. | 46% | C. | 44% | D. | 50% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 购买包装食品时关注生产日期和保质期 | |
| B. | 发霉的花生蒸煮后可食用 | |
| C. | 用亚硝酸钠代替食盐烹调食物 | |
| D. | 用福尔马林保鲜海产品 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
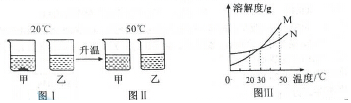
| A. | 图Ⅲ中M表示乙物质的溶解度曲线 | |
| B. | 图Ⅰ溶液中溶质质量分数:甲>乙 | |
| C. | 图Ⅱ中甲、乙溶液一定是不饱和溶液 | |
| D. | 30℃时,甲、乙溶液的溶质质量分数相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
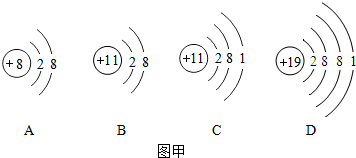
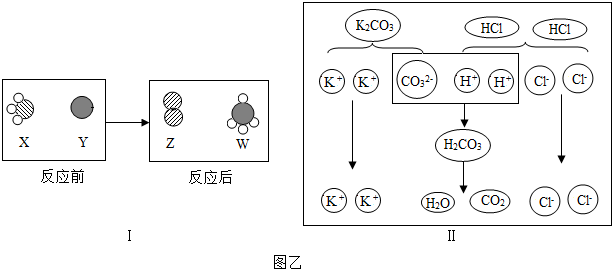
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 胃液中的胃酸(0.2%~0.4%的盐酸),可以杀死食物里的细菌,确保胃和肠道的安全,同时增加胃蛋白酶的活性,帮助消化,正常人胃液每日需要盐酸溶质质量约为6.5g~7.3g,某患者每日分泌盐酸溶质质量为9.0g,为治疗胃酸过多需服用图所示抑酸剂,请计算并回答:
胃液中的胃酸(0.2%~0.4%的盐酸),可以杀死食物里的细菌,确保胃和肠道的安全,同时增加胃蛋白酶的活性,帮助消化,正常人胃液每日需要盐酸溶质质量约为6.5g~7.3g,某患者每日分泌盐酸溶质质量为9.0g,为治疗胃酸过多需服用图所示抑酸剂,请计算并回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com