
【题目】空气是宝贵的自然资源,下图是以空气等为原料合成尿素CONH22的流程。请按要求回答相关问题:
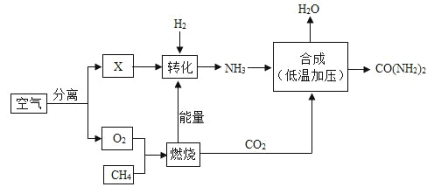
①空气属于________(填“纯净物”或“混合物”),X 是空气中含量最多的气体,其化学式为________________。图中分离空气的过程属于______变化(填“物理”或“化学”)。
②空气中含有的少量稀有气体的化学性质_______(填“活泼”或“稳定”)。工业上用煅烧石灰石制取二氧化碳的化学反应方程式为__________________;反应类型为______反应(填“化合”或“分解”)。
③天然气的主要成分是CH4,天然气属于______再生资源(填“可”或“不可”)。点燃CH4之前应_________。甲烷完全燃烧的化学反应方程式为_______________。由CH4在该流程中的作用表明:化学反应中发生物质变化的同时也会伴随有______变化(填“能量”或“原子个数”)。
④尿素是一种优质氮肥化学式(CONH22),尿素的摩尔质量为_______;1mol尿素分子中含有____mol原子,CONH22中碳、氧、氮、氢原子的个数比为_______,0.1mol尿素含有_________个尿素分子。
【答案】混合物 N2 物理 稳定 CaCO3![]() CaO+CO2↑ 分解 不可 验纯 CH4+2O2
CaO+CO2↑ 分解 不可 验纯 CH4+2O2![]() CO2↑+2H2O 能量 60g/mol 8 1:1:2:4 6.02×1022
CO2↑+2H2O 能量 60g/mol 8 1:1:2:4 6.02×1022
【解析】
①空气中含有氮气、氧气等多种物质,属于混合物;空气中含量最多的气体是体积分数占78%的氮气,其化学式为N2;分裂空气得到氧气和X,X主要含有氮气,没有新物质产生,属于物理变化。
②空气中少量的稀有气体也曾叫做惰性气体,化学性质稳定;石灰石的主要成分是碳酸钙,生石灰的主要成分是氧化钙,碳酸钙在高温条件下反应生成氧化钙和二氧化碳,该反应的化学方程式为:CaCO3![]() CaO+CO2↑;该反应由一种物质反应生成两种物质,为分解反应。
CaO+CO2↑;该反应由一种物质反应生成两种物质,为分解反应。
③甲烷是天然气的主要成分,是不可再生资源,点燃任何可燃性的气体之前,都必须要检验纯度,否则可能发生爆炸;甲烷燃烧生成了二氧化碳和水,反应的方程式是:CH4+2O2![]() CO2↑+2H2O;根据流程图可知,化学反应中发生物质变化的同时也会伴随有能量变化。
CO2↑+2H2O;根据流程图可知,化学反应中发生物质变化的同时也会伴随有能量变化。
④摩尔质量即1摩尔物质的质量,在数值上等于其相对分子质量,尿素的分子式为CONH22,相对分子质量为:12+16+(14+1×2)×2=60,故尿素的摩尔质量为:60g/mol;一个尿素分子是由一个碳原子、一个氧原子、两个氮原子和四个氢原子构成的,则尿素分子中,碳、氧、氮、氢原子的个数比为1:1:2:4;每1mol尿素含有尿素分子为6.02×1023,则0.1mol尿素含有尿素分子有0.1×6.02×1023=6.02×1022个尿素分子。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】“元旦”假期,小兵对“锌与硫酸反应快慢的影响因素”进行了探究。
(提出问题)锌与硫酸反应的快慢受哪些因素影响呢?
(猜想与假设)a.可能与硫酸的质量分数有关; b.可能与锌的形状有关。
(设计并实验)小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
实验编号 | 硫酸的质量分数 (均取20 mL) | 锌的形状 (均取1 g) | 氢气的体积(mL) (均收集3分钟) |
① | 20% | 锌粒 | 31.7 |
② | 20% | 锌片 | 50.9 |
③ | 30% | 锌粒 | 61.7 |
④ | 30% | 锌片 | 79.9 |
(1)写出稀硫酸与锌反应的化学方程式__________。
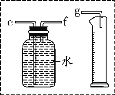
小兵用如图装置收集并测量氢气的体积,量筒的作用是_____,氢气应从_____(填e或f或g)管通入。
(收集证据)(3)比较不同浓度的硫酸对反应快慢的影响,选择的编号是_______。
(得出结论)(4)结论是_______。
(评价与反思)(5)下表是小兵第①组实验的详细数据。
时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
H2的体积 | 3.1 mL | 16.7 mL | 11.9 mL | 9.6 mL | 7.6 mL | 6.0 mL |
请描述锌与硫酸反应快慢的变化并解释原因______。
(6)锌与硫酸反应的快慢可能还受哪些因素影响?设计实验验证。_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国科学家屠呦呦因为发现青蒿素(一种用于治疗疟疾的药物),获得2015年诺贝尔医学奖。青蒿素是治疗疟疾的特效药,化学式为C15H22O5,下列关于青蒿素的说法错误的是
A. 青蒿素由碳元素、氢元素和氧元素组成的
B. 青蒿素分子是由碳原子、氢原子和氧原子构成的
C. 青蒿素是由15个碳原子、22个氢原子和5个氧原子构成的
D. 每个青蒿素分子中共有42个原子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学课堂上要学习碱的化学性质,老师让两位同学和他共同做实验,要求两位同学分别向澄清石灰水和氢氧化钠溶液中吹气,如图①②所示,老师告诉同学们,呼出的气体中只有二氧化碳有可能与澄清石灰水和氢氧化钠溶液反应.

同学们在吹气后观察到①中_______,②中氢氧化钠溶液无明显现象.观察实验现象后老师问,通过实验现象的观察,检验CO2气体应该使用_______,针对②的情况,师生共同开始探究之旅。
(提出问题) 如何通过实验证明CO2与NaOH发生了反应。
(查阅资料)
①CaCl2+Na2CO3=CaCO3↓+2NaCl; Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
②向CaCl2溶液中通入CO2,无明显现象;在水溶液中CaCl2不与CO2、H2CO3等物质反应.
(实验探究)
(实验一)证明反应物之一CO2消失了
(1)同学们设计了如如图所示的实验,打开分液漏斗活塞.向充满CO2的广口瓶中滴入NaOH溶液.一会儿后可观察到的实验现象是_____。
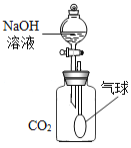
并据此现象判断NaOH与CO2发生了化学反应。
老师提出上述实验不足以证明NaOH与CO2发生了化学反应.你认为上述实验应做的改进是_____________。
(实验二)证明有新物质Na2CO3生成同学们经过思考、讨论,分别设计了以下两个实验方案:
方案一:打开瓶塞,向实验一所得的溶液中加入饱和的石灰水,若观察到有白色沉淀产生,证明有新物质Na2CO3生成。
方案二:打开瓶塞,向实验一所得的溶液中加入CaCl2溶液,若观察到有白色沉淀产生,证明有新物质Na2CO3生成。
(2)你认为上述实验方案不可行的是_______(填“方案一”或“方案二”),理由是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】高氯酸钾(KClO4)可用作火箭推进剂,其溶解度如下表。下列说法不正确的是( )
温度/℃ | 20 | 40 | 60 | 80 |
溶解度/g | 1.68 | 3.73 | 7.3 | 13.4 |
A. 高氯酸钾的溶解度随温度降低而减小
B. 80℃的高氯酸钾饱和溶液冷却至40℃一定有晶体析出
C. 60℃时,高氯酸钾饱和溶液中溶质的质量分数小于7.3%
D. 20℃时,向2g高氯酸钾中加入98g水,所得溶液的溶质质量分数为2%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】多彩的“碳”,多姿的生活,让我们一起走进“碳”的世界。
(1)化石燃料主要包括煤、_______和天然气,他们都含有碳元素,含碳物质的燃烧会导致过多的_______排放,加剧了“温室效应”。其中天然气的主要成分是_______(写化学式)请写出其完全燃烧的化学方程式是___________ 。
(2)现在化石燃料等不可再生能源面临枯竭,化石燃料对环境的影响也不容忽视。所以,开发和利用风能、_____________等新能源成为越来越迫切地要求。
(3)2013年3月,浙江大学实验室里诞生了世界上最轻的材料——“碳海绵”,它由碳元素组成,具有多孔结构,弹性好,对石油有很强的吸附能力(不吸水),将吸入的石油挤出后仍可恢复原状。关于碳海绵的说法正确的是_______(填字母序号)。
A.具有吸附性 B.可重复利用 C.可处理海上石油泄漏
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】乙醇不完全燃烧时产生CO、CO2和H2O。依据下表数据分析得出的结论中,不正确的是:
物质 | 乙醇 | 氧气 | 二氧化碳 | 水 | 一氧化碳 |
反应前质量/g | 6.6 | 8.8 | 0 | 0 | 0 |
反应后质量/g | 2 | 0 | 6.6 | 5.4 | a |
A. 表中的a值为1.4 B. 在化学反应前后碳元素质量一定相等
C. 参加反应的乙醇和氧气的质量比为3:4 D. 生成的CO和CO2分子个数比为1:3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是“电解水实验”的装置图,根据所学知识回答问题:
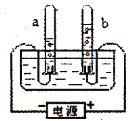
(1)根据图中的现象可知,a试管内收集的气体是:____,b试管内收集到的气体是:_________。
(2)检验试管a中气体的方法是____________;检验试管b中气体的方法是_____________。
(3)实验前在水中加入少量硫酸或氢氧化钠的目的是__________。
(4)该反应的文字或符号表达式为__________________________。
(5)通过该实验能得到的结论是______________。(答出一点即可)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是镉元素在元素周期表中的信息和镉原子结构示意图。下列说法错误的是( )

A. 镉是一种对人体有害的金属元素
B. 镉的原子序数和原子核内中子数均为48
C. 镉的相对原子质量为112.4
D. 化学反应中,镉原子易失电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com