
 ,试判断该原子最外层电子数为7,质子数为9,已知该原子的相对原子质量是19,则其中子数为10,该元素属于非金属(填“金属”或“非金属”)元素.
,试判断该原子最外层电子数为7,质子数为9,已知该原子的相对原子质量是19,则其中子数为10,该元素属于非金属(填“金属”或“非金属”)元素. 分析 原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层.若最外层电子数≥4,则一般为非金属元素,在化学反应中易得电子,若最外层电子数<4,则一般为金属元素,在化学反应中易失去电子.根据相对原子质量=质子数+中子数判断中子数.
解答 解:由原子结构示意图可知,该原子最外层电子数为7,质子数为9;已知该原子的相对原子质量是16,由于相对原子质量=质子数+中子数,所以,中子数=19-9=10;由于最外层电子数是7大于4,该元素属于非金属元素.
故答案为:7;9;10;非金属.
点评 本题难度不大,考查学生对原子结构示意图及其意义的理解,了解原子结构示意图的意义是正确解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:实验探究题
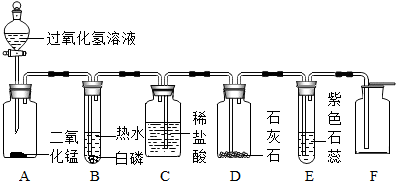
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
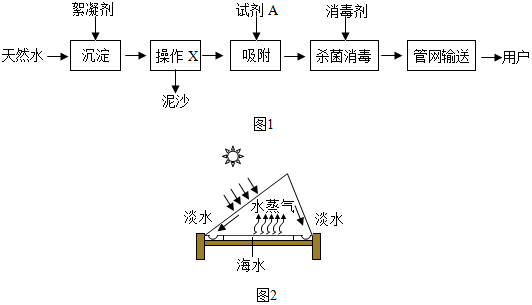
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用pH试纸不能区分肥皂水和食醋 | |
| B. | 用灼烧的方法能区别棉花和羊毛 | |
| C. | 用适量的水能区分NH4NO3固体和NaOH固体 | |
| D. | 用饱和(NH4)2SO4溶液能区分食盐水和氢氧化钠溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com