
【题目】(7分)金属及金属材料在生产、生活中应用广泛。
(1)铜可以拉成铜丝,这是利用金属的_________。
(2)铝具有很好的抗腐蚀性能,原因是 (用化学方程式表示)。
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图所示),纯铜片上留下明显的划痕,该实验说明了 。

(4)写出高炉炼铁中CO还原氧化铁的化学反应方程式 。
(5)铜器在潮湿的空气中也容易生锈,铜锈(俗称铜绿)的主要成分是Cu2(OH)2CO3,结合其组成分析,铜生锈是铜与水、 和 共同作用的结果。
(6)新型材料纳米级Fe粉能用作高效催化剂。实验室采用还原法制备纳米级Fe粉,其流程如下图所示(通入N2的目的是防止生成的纳米级铁粉被氧化):

写出Ⅱ中H2还原FeCl2置换出铁的化学方程式 。
【答案】(1)延展性
(2)4Al + 3O2===2Al2O3
(3)黄铜的硬度比纯铜的大
(4)Fe 2O3 + 3CO![]() 2Fe + 3CO2
2Fe + 3CO2
(5)O2 、CO2
(6)H2+FeCl2![]() Fe + 2HCl
Fe + 2HCl
【解析】
试题分析:(1)铜可以拉成铜丝,这是利用金属的延展性;
(2)铝具有很好的抗腐蚀性能,原因是铝易与空气中的氧气反应生成一层致密的氧化铝薄膜,能阻止铝的进一步氧化:4Al + 3O2===2Al2O3;
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如右图所示),纯铜片上留下明显的划痕,该实验说明了黄铜的硬度比纯铜的大;
(4)一氧化碳还原氧化铁生成的是铁和二氧化碳:Fe 2O3 + 3CO![]() 2Fe + 3CO2;
2Fe + 3CO2;
(5)依据质量守恒定律化学反应前后元素的种类不变,那么可知铜生锈是铜与水、氧气和二氧化碳共同作用的结果;
(6)依据质量守恒定律化学反应前后元素的种类不变,H2还原FeCl2置换出铁的同时还生成了盐酸:
H2+FeCl2![]() Fe + 2HCl 。
Fe + 2HCl 。


科目:初中化学 来源: 题型:
【题目】(2分)含锌30%的黄铜用作弹壳的制造。现有一批使用过的、锈迹斑斑的弹壳,处理这些弹壳可以制得铜和硫酸锌,其主要过程如下图所示。
提示:弹壳上的锈主要为Cu2(OH)2CO3,能与稀硫酸反应得到硫酸铜溶液;弹壳中其他杂质不溶于水、不参加反应。
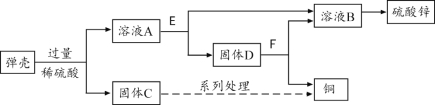
(1)固体D为 。
(2)溶液A中加入E后发生反应的化学方程式为 。
查看答案和解析>>
科目:初中化学 来源: 题型:
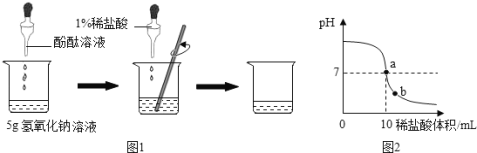
【题目】(6分)为测定一瓶氢氧化钠溶液的质量分数,小张同学进行了以下实验:
如图1所示,在烧杯中加入5g氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入1% 的稀盐酸,并不断搅拌,至溶液颜色恰好变为无色为止。
请回答:
(1)酚酞溶液的作用是 。
(2)当溶液颜色恰好变为无色时,共用去稀盐酸7.3g,则该氢氧化钠溶液中溶质的质量分数为 。
(3)在以上实验操作中,如继续滴加1%稀盐酸,并不断搅拌,则整个实验过程中溶液pH的变化曲线如图2所示。
①a点表示的含义是 ;
②b点溶液中含有的阳离子有 (填离子符号)。
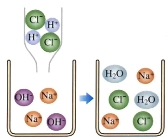
(4)下图是盐酸滴入氢氧化钠溶液中有关粒子之间反应的示意图。由此可看出,盐酸与氢氧化钠能发生反应的原因是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】相关叙述正确的是
A.溶液就是均一、稳定的液体
B.某物质的饱和溶液的溶质质量分数一定比不饱和溶液大
C.溶液中溶质的质量分数可以表示每100g溶液中溶质的质量
D.溶液的溶质质量分数越大,溶质的质量越大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(5分)人体缺乏维生素C(简称“Vc”)就会患坏血病,如图所示为某种“维生素C”药片说明书的一部分。其中,维生素C“化学式”部分残缺,用“C6H8On”表示。

(1)维生素C中碳和氢元素的质量比是____________。
(2)如果按照说明书的要求服用“维生素C”药片,每天可以补充维生素C的质量为 mg。
(3)维生素C的相对分子质量为176,则维生素C化学式中n为 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(8分)某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲设计以下对比实验:
Ⅰ.将3.0 g KClO3与1.0 g MnO2均匀混合加热。
Ⅱ.将x g KClO3与1.0 g CuO均匀混合加热。
在相同温度下,比较两组实验产生O2的快慢。
Ⅰ中反应的化学方程式是 ;Ⅱ中x的值应为________。
(2)乙探究了影响双氧水分解速度的某种因素。反应的化学方程式为 ,有关实验数据记录如下:
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2质量 | |
Ⅰ | 50.0 g | 1% | 0.1 g | 0.013 mg |
Ⅱ | 50.0 g | 2% | 0.1 g | 0.023 mg |
Ⅲ | 50.0 g | 4% | 0.1 g | 0.044 mg |
本实验中,测量O2质量应用了图的装置。根据实验装置实验所依据的原理是 。
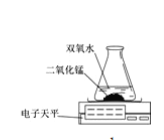
实验结论:在相同条件下,________,双氧水分解得越快。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(10分)如图为“хх”钙片商品标签图,请根据标签的有关信息完成下列各题.

该钙片主要成分碳酸钙,碳酸钙的相对分子质量为 ① .
某校化学兴趣小组为了确认标签中碳酸钙的含量是否真实,决定通过实验进行探究.
实验目标:测定该钙片主要成分碳酸钙的含量.
实验原理:取一定质量的钙片与足量的稀盐酸反应,测量生成的CO2的质量(已知该状态下CO2的密度),然后计算其中碳元素的质量,利用反应前后碳元素的质量不变,再计算出碳酸钙的质量.
实验方案:兴趣小组的同学们经过思考提出了以下几种实验方案,请你参与他们对实验方案的讨论、取舍.
方案一:甲同学设计了如图所示的装置,通过反应后右侧注射器(注射器最大量程为20mL)内收集到气体的量来进行计算.
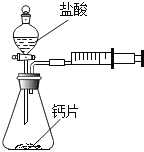
(1)同学们观看了他的设计后,都认为该方案中样品的取用的量需要一定的控制,这是因为 .
(2)同学们讨论后,一致认为注射器的摩擦会影响生成的CO2的完全收集.
方案二:乙同学设计了如图所示的装置,与甲同学的相比,仅仅在收集方法上不同.
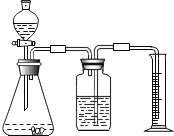
(1)同学们观看了他的设计后,都认为所测得CO2气体的体积将会 ① (填偏大或偏小),你认为他们的理由是 ② ,你的改进方案是 ③ ;广口瓶内原有的空气对实验结果 ④ (填“有”或“没有”)影响.
(2)同学们讨论后,一致认为把装置改进后测得生成的CO2气体体积会偏大,你认为他们的最主要理由是 .
方案三:丙同学设计了如图所示的装置.同学们观看后一致认可他的设计,并按照他的思路设计了以下实验步骤.
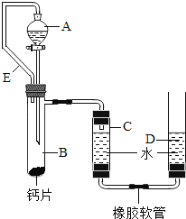
实验步骤:
①连接装置并检查装置气密性;
②加入10片钙片和水;
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加稀盐酸至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为V mL(经查,该气体密度为ρg/L);
⑥计算气体的质量.
实验反思:
(1)丙同学在实验前将钙片全磨成粉末状,你认为他的目的是: ;
(2)检查该装置的气密性时,如图准备好装置,在C、D两管中装好水且液面相平,提高D管, ,则气密性良好;
(3)实验结论:经多次实验(钙片都是10片),所得CO2气体的平均质量是6.82g,请你最后计算确认标签中碳酸钙的含量是 (填“真实”或“不真实”)的.(最后一空不需要写计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com