
| A. | 青蒿素属于有机物 | |
| B. | 青蒿素分子中碳、氢、氧的原子个数比为15:22:5 | |
| C. | 青蒿素的相对分子质量282g | |
| D. | 青蒿素由碳、氢、氧三种元素组成 |
分析 A.根据有机物与无机物的概念来分析;
B.根据分子结构来分析;
C.根据相对分子质量的单位来分析;
D.根据物质的组成来分析.
解答 解:A.由青蒿素的化学式可知,青蒿素是一种含碳元素的化合物,属于有机化合物,故正确;
B.1个青蒿素分子是由15个碳原子、22个氢原子和5个氧原子构成的,则青蒿素分子中碳、氢、氧的原子个数比为15:22:5,故正确;
C.相对分子质量的单位是“1”而不是“g”,通常省略不写,故错误;
D.由化学式可知,青蒿素是由碳、氢、氧三种元素组成的,故正确.
故选C.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 40 | 10 | 10 | 0 |
| 反应后质量/g | 6 | M | 28 | 16 |
| A. | 甲是化合物 | B. | 乙可能是催化剂 | ||
| C. | M=38 | D. | 此反应为分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 乙醇的分子结构模型如图所示,则下列叙述不正确的是( )
乙醇的分子结构模型如图所示,则下列叙述不正确的是( )| A. | 乙醇是由三种元素组成的化合物 | B. | 一个乙醇分子中含有26个质子 | ||
| C. | 乙醇中碳、氧元素的质量比为2:1 | D. | 乙醇中碳元素的质量分数最大 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
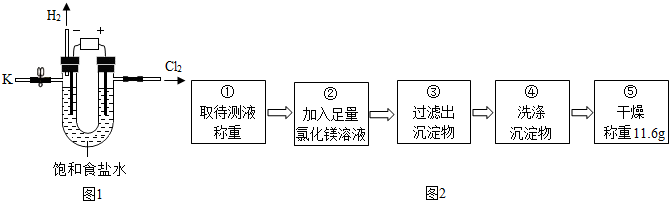
| 实验步骤 | 实验现象 | 实验结论 |
| 向待测液中滴加几滴酚酞试液 | 酚酞试液变红色 | 待测液呈碱性,说明含有氢氧化钠. |
| 加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 | 11 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 | 2.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 该反应属于化合反应 | |
| B. | 该反应中Li元素的化合价发生了改变 | |
| C. | LiMnO2属于氧化物 | |
| D. | 锂电池板是化学能转化为电能装置 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com