
【题目】(1)良好的生态环境、饮食习惯可以提升生活质量。
①近期雾霾天气影响了很多人的生活。导致雾霾形成的主要污染物是______(填字母)。
a.SO2 b.NO2 c.PM2.5
②燃料不完全燃烧会对环境有污染。46g酒精在88g氧气中恰好完全反应,生成66g二氧化碳54g水以及第三种物质。请根据数据得出第三种物质的化学式______,并写出该反应的化学方程式______。
③垃圾无害化处理有利于保护环境。下列有关生活垃圾的处理合理的是_______。
a.用厨余垃圾生产沼气 b.废旧塑料露天焚烧 c.废旧电池就地填埋
④新鲜蔬菜富含维生素C,蔬菜生吃比熟吃时维生素C的损失小,由此推测维生素C可能具有的化学性质有______。
(2)材料的不断发展可以促进社会进步。
①铝制品不易生锈的原因是______。
②氮化硅(Si3N4)是一种新型高温材料,由高纯硅和氮气在1300℃时反应制的。化学方程式为______。
(3)防止食品变质,常在包装袋中放一袋干燥剂。
①写出干燥剂氧化钙吸水的化学方程式______。
②取24.8g长期暴露在空气中的氧化钙样品,加入足量的盐酸,产生CO2 4.4 g,再向剩余溶液中加入足量的Na2CO3溶液,充分反应后,过滤得到沉淀质量为30g。根据上述数据判断,样品固体中碳酸钙的质量为___g,____(填“存在”或“不存在”)氧化钙。
【答案】 c CO 4C2H6O+11O2![]() 6CO2+12H2O+2CO a 受热性质会变化 铝在空气中易与空气中的氧气反应生成致密的氧化铝膜 3Si+2N2
6CO2+12H2O+2CO a 受热性质会变化 铝在空气中易与空气中的氧气反应生成致密的氧化铝膜 3Si+2N2![]() Si3N4 CaO+H2O=Ca(OH)2 10 不存在
Si3N4 CaO+H2O=Ca(OH)2 10 不存在
【解析】(1)①导致雾霾形成的主要污染物是PM2.5,故选c。②酒精不充分燃烧有一氧化碳气体生成,根据质量守恒定律,生成一氧化碳的质量是:46g+88g-66g-54g=14g,C2H6O+O2 ![]() CO2+H2O+CO ,各物质的分子个数比为:
CO2+H2O+CO ,各物质的分子个数比为:![]() :
:![]() :
:![]() :
:![]() :
:![]() =4:11:6:12:2,所以反应的化学方程式为:4C2H6O+11O2
=4:11:6:12:2,所以反应的化学方程式为:4C2H6O+11O2![]() 6CO2+12H2O+2CO ③a.用厨余垃圾生产沼气,变废为宝,正确;b.废旧塑料露天焚烧,产生有害气体,错误;c.废旧电池就地填埋会对水土造成严重污染,错误。故选a。④新鲜蔬菜富含维生素C,蔬菜生吃比熟吃时维生素C的损失小,由此推测维生素C可能具有的化学性质有受热性质会变化。(2)①铝制品不易生锈的原因是,铝在空气中易与空气中的氧气反应生成致密的氧化铝膜,阻止铝进一步氧化。②根据题意反应的化学方程式为:3Si+2N2
6CO2+12H2O+2CO ③a.用厨余垃圾生产沼气,变废为宝,正确;b.废旧塑料露天焚烧,产生有害气体,错误;c.废旧电池就地填埋会对水土造成严重污染,错误。故选a。④新鲜蔬菜富含维生素C,蔬菜生吃比熟吃时维生素C的损失小,由此推测维生素C可能具有的化学性质有受热性质会变化。(2)①铝制品不易生锈的原因是,铝在空气中易与空气中的氧气反应生成致密的氧化铝膜,阻止铝进一步氧化。②根据题意反应的化学方程式为:3Si+2N2![]() Si3N4(3)①氧化钙能与水反应生成氢氧化钙。②产生的4.4gCO2是碳酸钙与稀盐酸反应产生的,设样品固体中碳酸钙的质量为x。
Si3N4(3)①氧化钙能与水反应生成氢氧化钙。②产生的4.4gCO2是碳酸钙与稀盐酸反应产生的,设样品固体中碳酸钙的质量为x。
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
100 44
x 4.4g
![]() =
=![]() ,解得x=10g
,解得x=10g
则样品中其它物质的质量为:24.8g-10g=14.8g,由其它物质与碳酸钠反应生成沉淀的质量为:30g-10g=20g,设参加反应的氢氧化钙的质量是y。
根据化学方程式:Na2CO3 + Ca(OH)2 == CaCO3↓+ 2NaOH,
74 100
y 20g
![]()
![]() =
=![]() ,解得y=14.8g,所以样品固体中不存在氧化钙。
,解得y=14.8g,所以样品固体中不存在氧化钙。


科目:初中化学 来源: 题型:
【题目】下列图像与相应操作对应正确的是( )
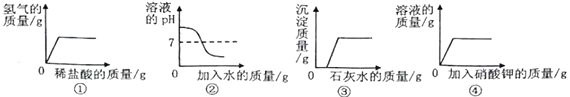
A. ①向一定量锌粒中加入稀盐酸
B. ②向一定量氢氧化钠溶液中加入水
C. ③向一定量氢氧化钠和碳酸钠的混合溶液中加入石灰水
D. 一定温度下,向一定量接近饱和的硝酸钾溶液中加入硝酸钾固体
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某品牌可乐汽水、白砂糖、焦糖色素(使可乐显黑褐色)、磷酸(H3PO4)等按一定比例混合并压入二氧化碳配制而成。
(1)磷酸中H、P、O三种元素的质量比为_______________。
(2)某同学为了定量测定可乐中磷酸的含量,进行如下实验
步骤1:取可乐样品25mL,加入活性炭,浸泡、过滤、洗涤。
步骤2:将滤液煮沸10min,冷却,加入适量蒸馏水。
步骤3:继续往滤液中加几滴某指示剂,再逐滴滴入0.1%的NaOH溶液20g,恰好完全反应。(测定原理: H3PO4+NaOH=NaH2PO4+H2O)
①步骤1中活性炭的作用是_____________________
②步骤2中“煮沸10min"能除尽滤液中CO2的原因之一是当温度升高时,气体的溶解度_______(填“变大”“变小”或“不变”)。
③计算1L可乐中磷酸的含量_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】溶质质量分数为10%的KNO3 溶液可用来配制花卉、盆栽植物的营养液。请回答:
(1)KNO3溶液能给花卉、盆栽植物提供需要量较大的营养元素是_______________。
(2)某同学用KNO3固体配制100g 10%的KNO3 溶液的过程如下(水的密度为1.0g/mL):
①计算:需要KNO3的质量是10g,水90g。
②称量:用托盘天平称量KNO3的质量。天平调零后,分别在天平左右托盘放上质量相同的纸片。先向右盘添加10g砝码 ,然后向左盘慢慢添加 KNO3直至天平平衡。
③量取:往量筒中倒入一定量的水后(见下图1),接下来的实验操作是_______________。
④溶解:将称量出的固体和量取到的水依次倒入烧杯中,用玻璃棒搅拌至固体全部溶解。
⑤装瓶贴标签:请在标签上写上内容(见下图2)。
 _______________
_______________
(3)将上述配好的100g溶液稀释成0.8%的稀溶液,需要加入_________________g水。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学活动小组用镁和铁探究金属的反应规律。
【查阅资料】
①镁,铁的活动性均在 H 之前并且镁比铁活泼。
②相同条件下,相同时间内金属的活动性越强,与酸反应越剧烈,产生的氢气越多。
【探究一】在室温条件下进行如图所示实验。试管内的镁带和铁片表面均被打磨洁净,且形 状、大小相同;同时加入等质量和等浓度的稀盐酸。
(1)该兴趣小组的同学认为该方案中长颈漏斗起非常重要的作用。
①通过相同条件下,相同时间内长颈漏斗中 __________
②长颈漏斗在实验中还可以起_________________ 作用。
(2)在甲、乙装置的水中滴入 2~3 滴红墨水的目的_______________。
(3)乙装置中反应方程式为______________,该反应属于基本反应类型中的_______反应。
(4)观察到甲装置中产生气泡速率比乙装置快或 __________现象时,都可以证明镁的金属活动性比铁的强。
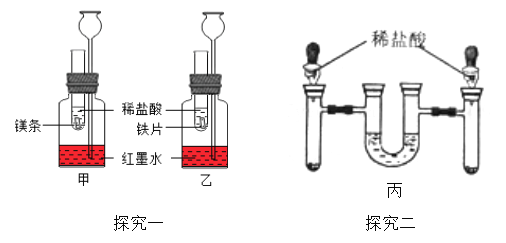
【探究二】方案二:如图丙,将等质量光亮洁净,形状厚薄相同的镁条和铁片分别放入左、 右试管中,加入等质量、等质量分数的稀盐酸,充分反应后,冷却到室温,金属均有剩余,(U 型管内为水,初始液面相平,反应过程中装置气密性良好)。
(5)实验过程中 U 型管中液面 _______(填“左高右低”,“左低右高”,“相平”); 充分反应后,冷却到室温 U 型管中液面 ___________填“左高右低”,“左低右高”,“相平”),原因是_____。
【探究三】在硫酸铜和硫酸亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出 的固体中滴加稀硫酸,没有气泡产生。下列判断正确的是 ________。写成发生反应的化学方程式 ________ 。
A.滤出的固体中一定含有铜 B.滤出的固体可能含有铁和镁
C.滤液中可能含有硫酸铜 D.滤液中一定含有硫酸镁和硫酸亚铁
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是实验室制取气体时常用的发生装置,请回答下列问题:

(1)仪器①的名称为______________。
(2)实验室常用加热无水醋酸钠和碱石灰两种固体的混合物制取甲烷,可选的发生装置为_______(填字母),可用_____________法收集甲烷,实验室利用该装置还可制取的常见气体为____________(填化学式)。
(3)若选用装置B制取气体,则反应物的状态和反应条件分别为_____________、_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知硝酸钾在不同温度下的溶解度如下表:
温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度/g | 32 | 46 | 64 | 85.5 | 110 | 138 | 170 |
甲是80℃含有100 g水的KNO3溶液,操作过程如下图所示。以下分析错误的是
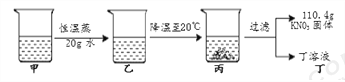
A. 甲、乙、丙、丁四种溶液中,饱和溶液只有2种
B. 甲到乙的过程中,溶质质量没有改变
C. 甲溶液中,溶剂与溶质的质量比为25: 34
D. 甲溶液冷却时,开始析出固体的温度在60℃~70℃之间
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是四种粒子的结构示意图,下列说法正确的是( )
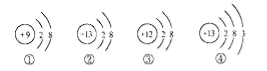
A.②③属于同种元素 B.②④的化学性质相同
C.②的符号为Al+3 D.①③形成的化合物是MgF2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】地沟油中含有一种强烈致癌物黄曲霉素B2(C17H14O6),长期食用会引起消化道癌变,请回答:
(1)黄曲霉素B2中碳、氢、氧三种元素的原子个数比为__________________。
(2)黄曲霉素B2的相对分子质量为___________。
(3)15.7g黄曲霉素B2中含有___________ g氧元素。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com