

分析 (1)①根据活性炭具有吸附性分析回答.
②根据煮沸能减少水中钙、镁化合物的含量分析回答.
③根据质量守恒定律和化合价原则分析回答.
(2)①写出甲烷的化学式.②根据燃烧的条件分析回答.
(3)①根据物质的组成对PX分类;
②根据PX在空气中完全燃烧的反应写出化学方程式;
③根据PX的性质、变化和用途分析回答.
解答 解:(1)①由于活性炭具有吸附性,水中难闻的异味,可添加活性炭除去,这是利用了活性炭的吸附性.
②煮由于沸能减少水中钙、镁化合物的含量,初步净化后的水,可以通过煮沸方法,降低水的硬度.
③“84消毒液”可用于灾区防疫.制备其主要成分次氯酸钠(NaClO)的化学方程式为:2NaOH+X=NaC1O+NaCl+H2O,由质量守恒定律反应前前后原子的种类及数目不变可知,则X的化学式为Cl2;在NaClO中,由于钠的化合价为+1价,氧的化合价为-2价,则可求出Cl的化合价为+1.
(2)①海底埋藏着大量的“可燃冰”,将成为未来的新能源,其主要成分是甲烷水合物,甲烷的化学式为CH4.
②在做“燃烧的条件”实验时,把同样大小的滤纸碎片和乒乓球碎片分开放在一块薄铜片的两侧(已知该种品牌的乒乓球材质的着火点比滤纸低),加热铜片的中部,观察到的现象是乒乓球碎片先燃烧,通过此实验,说明燃烧的条件之一是温度需达到可燃物的着火点.
(3)①PX是含有碳元素的化合物,它属于有机物;
②在空气中完全燃烧生成了二氧化碳和水,反应的化学方程式是:2C8H10+21O2$\frac{\underline{\;点燃\;}}{\;}$16CO2+10H2O;
③应正确地认识PX项目的利与弊,从PX性质看,具有可燃性,爆炸性比汽油低,毒性与汽油相当,对人体危害小;从燃烧产物看,PX燃烧产物是水和二氧化碳,对环境几乎没有危害;从PX用途看,应用广泛,能够提高人们的生活质量,经济和社会价值显著.综上所述,利大于弊.
故答为:(1)①吸附,②煮沸,③Cl2,+1;
(2)①CH4,②乒乓球碎片,温度需达到可燃物的着火点;
(3)①有机物;②2C8H10+21O2$\frac{\underline{\;点燃\;}}{\;}$16CO2+10H2O;
③从PX性质看,具有可燃性,爆炸性比汽油低,毒性与汽油相当,对人体危害小;从燃烧产物看,PX燃烧产物是水和二氧化碳,对环境几乎没有危害;从PX用途看,应用广泛,能够提高人们的生活质量,经济和社会价值显著.综上所述,利大于弊.(答出其中一点即可以得分)
点评 本题与生活联系比较紧密,会利用化学的知识来分析解答生活中的一些问题是接单本题的关键.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:初中化学 来源: 题型:填空题
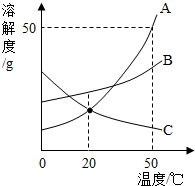 A.B.C两种固体的液解度曲线如图所示,回答问题:
A.B.C两种固体的液解度曲线如图所示,回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 阴离子 阳离子 | OH- | NO3- | Cl- | SO42- | CO32- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Ag+ | 溶 | 不溶 | 微溶 | 不溶 | |
| Ba2+ | 溶 | 溶 | 溶 | 不 溶 | 不 溶 |
| 操作步骤 | 实验现象 | 相应的结论 |
| (1)取样,溶于适量的水,静置,过滤.取少量滤液于一支试管中,滴加紫色石蕊试液. | 石蕊试液不变蓝色 | 没有OH-存在 |
| (2)另取少量滤液于另一支试管中,滴加稍过量的稀硝酸. | 无明显现象 | 没有CO32-存在 |
| (3)再向第2步所得溶液中继续滴加少量的 Ba(NO3)2溶液 | 无明显现象 | 没有SO42-存在 |
| (4)向第3步所得溶液中再滴加少量硝酸银溶液 | 有白色沉淀产生 | 有Cl-存在 |
| (5)取白色糊状物,滴加少量碘水或碘酒 | 有蓝色出现 | 则说明有淀粉存在 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题


查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 出行方式尽量采用步行,骑自行车或公交车 | |
| B. | 减少制造垃圾,实行垃圾分类 | |
| C. | 随手关灯和关水龙头,节约用水用电 | |
| D. | 为节约粮食将霉变的大米,花生等蒸煮食用 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com