课外化学兴趣小组的同学利用某化工厂的废碱液(主要成分为Na
2CO
3,还含有少量NaCl,其它杂质不计)和石灰乳为原料制备烧碱,并对所得的烧碱粗产品的成分进行分析和测定.
【粗产品制备】
(1)将废碱液加热蒸发浓缩,形成较浓的溶液,冷却后与石灰乳混合,发生反应的化学方程式为
Na2CO3+Ca(OH)2═2NaOH+CaCO3↓
Na2CO3+Ca(OH)2═2NaOH+CaCO3↓
.
(2)将反应后的混合物过滤,得到的滤液进行蒸发结晶,制得NaOH粗产品.
【粗产品成分分析】
(1)取适量粗产品溶于水,滴加Ba(NO
3)
2溶液出现白色浑浊,发生反应的化学方程式为
Ba(NO3)2+Na2CO3═BaCO3↓+2NaNO3
Ba(NO3)2+Na2CO3═BaCO3↓+2NaNO3
,该粗产品中一定不含有
氢氧化钙
氢氧化钙
,理由是
滴加硝酸钡产生沉淀,说明产品中含有碳酸钠,碳酸钠能与氢氧化钙发生反应,二者不能共存
滴加硝酸钡产生沉淀,说明产品中含有碳酸钠,碳酸钠能与氢氧化钙发生反应,二者不能共存
.
(2)该小组同学通过对粗产品成分的实验分析,确定该粗产品中含有三种物质.
【粗产品中Na
2CO
3含量测定】
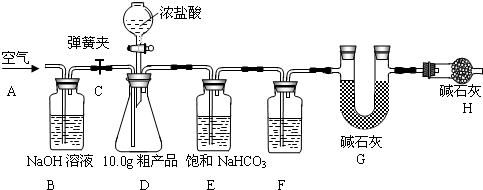
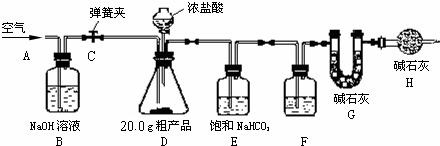
(1)该兴趣小组的同学设计了下图所示的实验装置.取10.0g粗产品,进行实验.
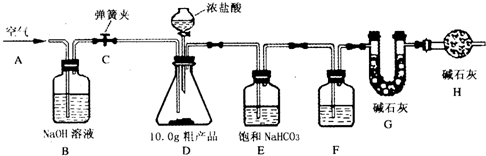
(2)操作步骤
①连接好装置,检查气密性;②打开弹簧夹C,在A处缓缓通入一段时间空气;③称量G的质量;④关闭弹簧夹C,慢慢滴加浓盐酸至过量,直至D中无气泡冒出;⑤打开弹簧夹 C,再次缓缓通入一段时间空气;⑥再次称量G的质量,得前后两次质量差为0.48g.
(3)问题探究
①步骤②的目的是
排除装置内的空气,防止含有的二氧化碳对实验结果造成干扰
排除装置内的空气,防止含有的二氧化碳对实验结果造成干扰
;
②B装置的作用是
吸收空气中的二氧化碳
吸收空气中的二氧化碳
,F中的试剂应为
浓硫酸
浓硫酸
;
③E 装置的作用是
吸收除去挥发出的氯化氢气体
吸收除去挥发出的氯化氢气体
,相关反应的化学方程式是
NaHCO3+HCl═NaCl+H2O+CO2↑
NaHCO3+HCl═NaCl+H2O+CO2↑
,H装置的作用是
吸收空气中的二氧化碳
吸收空气中的二氧化碳
.若没有H装置,则测定的Na
2CO
3的质量分数会
偏大
偏大
(填“偏大”、“偏小”、“不变”).事实上10.0g粗产品只能产生0.44g CO
2.请你仔细分析上述实验,解释实验值0.48g比正确值0.44g偏大的原因(假设操作均正确)
装置D中浓盐酸挥发出的氯化氢与装置E中NaHCO3反应产生二氧化碳
装置D中浓盐酸挥发出的氯化氢与装置E中NaHCO3反应产生二氧化碳
.



 星级口算天天练系列答案
星级口算天天练系列答案