
 ʵ��̽���û�ѧ����������������������ʵ��̽��
ʵ��̽���û�ѧ����������������������ʵ��̽��| ��ɫ��ĩ�ijɷ� | �� �� �� ԭ �� |
| ������CaCO3 | ʯ��ˮ�������CO2��Ӧ�� ��ѧ����ʽΪ�� CO2+Ca��OH��2=CaCO3��+H2O CO2+Ca��OH��2=CaCO3��+H2O |
| ������ Ca��OH��2 Ca��OH��2 |
�������µ����ߣ����ʵ��ܽ�Ȼ� ��С ��С ������С�����ܼ�������ʯ��ˮ�е��������� |
| ʵ �� �� �� | ���ܹ۲쵽������ | �� �� |
| ȡ�����Թ��е��ϲ���Һ���μ�1��2����ɫ��̪��Һ | ��Һ��� | ��ɫ��ĩ�к�Ca��OH��2 ��ɫ��ĩ�к�Ca��OH��2 |
| �������Թ��ڲ����Ĺ����м���ϡ���� | �������� �������� |
��ɫ��ĩ�к���CaCO3 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ʵ�鲽�� | ʵ������ |
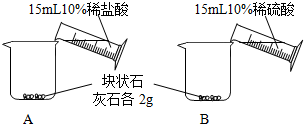 |
A�в��ϲ������ݣ��������٣�����������ʣ�࣮ B�п�ʼ���������ݲ�������Ӧ�ܿ�ֹͣ�� |
| ʵ�鲽�� | ʵ������ |
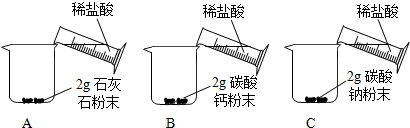 |
A��Ѹ�ٲ����������ݣ�����ܿ���٣�����������ʣ�࣮ B��C�ж�Ѹ�ٲ����������ݣ�����ܿ���ʧ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�������ʡ�������о��꼶һģ���Ի�ѧ�Ծ��������棩 ���ͣ�̽����
��ʵ���ң�������ͭ��̼��ơ�̼���ơ��������ơ�����������������(��Ϊ������)ʧȥ��ǩ�����Ǿ�Ϊ��ɫ��ĩ���ֽ�ҩƷ�ֱ���ΪA��B��C��D��E����ѧ��ʦ�û�ѧʵ��С���ͬѧ�������Щ���ʡ�
���������ϡ���ɫ������ͭ��ĩ��ˮ��Ϊ��ɫ
��ʵ��̽������ѧʵ��С���ͬѧ����ʵ����̼�¼���²���1��ȡ���ְ�ɫ��ĩ��һҩ�ף��ֱ������֧�ྻ���Թ��У���������ˮ2mL�����á���֧�Թܵײ����й�����ڣ�ֻ��ʢ��E���Թ���Һ�����ɫ�� ����������ɫ��
����2��ȡB��C��D���ϲ���Һ�μ�ϡ���ᣬֻ��B���Թ��������ݲ���������������������
����3��ȡA��C��D���ϲ���Һ�����Թ��У��ֱ�μ���ɫ��̪��A��C�Ժ�ɫ��
����ݸ�ѧ����ʵ����̣��ش��������⣺
��1���ɲ���1�ó�EΪ??????????????? ��
��2������3��D��������??????????????????????????? ��
��3�����ݸû�ѧС���ʵ�飬��E���������ְ�ɫ��ĩ�в���Ҳ����ȷ�����ֱ���?????????? ��(д���ż����Ӧ���ʵĻ�ѧʽ)
��4������δ������������ʣ������ʵ�����ȷ�����������±���
ʵ����� | ʵ�������� |
|
|
��ʵ�鷴˼������֧�Թܵײ����й�����������뻯ѧС��ͬѧԤ���ֻ��һֻ�Թ����й�������ڣ������Թ��о�Ϊ������Һ��������ͬ����ԭ�������???????????????????????? ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
ʵ��̽���û�ѧ����������������������ʵ��̽��
��1��ͬѧ�������ꡰ������̼��ʵ������ȡ���Է�Һ���������´��������ˣ�ȡ��Һ���ձ��У���ε���Na2CO3��Һ��������
��¼����Na2CO3��Һ����(x)���йصı仯��ϵ��ͼ
��ʾ��ͼ��������(y)��ʾ_______________��AB��
������Ӧ�Ļ�ѧ����ʽ��___________________ _____��
_____��
��Ӧ���е�A��ʱ����Һ�е�������______________��
 C��ʱ��Һ�� pH___ _(�����������������)7.
C��ʱ��Һ�� pH___ _(�����������������)7.
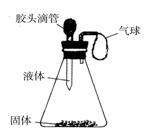
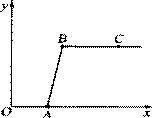 ��2����ͼ��ʾ��һͬѧ��ѹ��ͷ�ι��е�Һ�壬
��2����ͼ��ʾ��һͬѧ��ѹ��ͷ�ι��е�Һ�壬
ʹ֮��ƿ�й���Ӵ���С�������������
��д��������һ����Ļ�ѧ����ʽ��
���û���Ӧ_____________________ __��
__��
�ڻ��Ϸ�Ӧ_________________________��
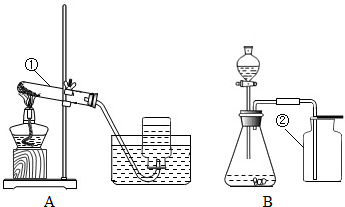
��3��ʵ�����У�ͬѧ�Ƿ���һƿʯ��ˮ�Լ�ƿƿ�ں�ƿ����Χ��һЩ��ɫ��ĩ.Ϊ��Ū�����ɫ��ĩ�ijɷּ��γ�ԭ��,���ǽ���������̽����
�ٶ�ɫ��ĩ�ɷֵIJ���ͳ������:
| ��ɫ��ĩ�ijɷ� | �� |
| ������CaCO3 | ʯ��ˮ�������CO2��Ӧ�� ��ѧ����ʽΪ�� |
| ������ | �������µ����ߣ����ʵ��ܽ�Ȼ� ��������С�����ܼ�������ʯ��ˮ�е��������� |
��������˼����ͬѧ����Ϊ��ɫ��ĩ�������������������ʵĻ����.
�����ʵ�飺��ͬѧȡ��ɫ��ĩװ���Թ���,����������ˮ����,�����а�ɫ���岻�ܽ⣬�������ó���ĩ��ֻ��CaCO3�Ľ��ۡ���ͬѧ�������ܽ��Ա�����Ϊ��ͬѧ�Ľ��۲����ܣ������ǣ� ��
Ϊ�˵ó������ܵĽ��ۣ����ǽ���������ʵ�飬���������ʵ�鱨�棺
| ʵ �� �� �� | ���ܹ۲쵽������ | �� �� |
| ȡ�����Թ��е��ϲ���Һ���μ�1��2����ɫ��̪��Һ | ��Һ��� |
|
| �������Թ��ڲ����Ĺ����м��� |
| ��ɫ��ĩ�к���CaCO3 |
�۽����뷴˼
ͨ������ʵ���̽����ͬѧ����ʵ����������桢ʹ���ױ��ʵ���Һʱ�����н��飬�������� ��A.�ܷⱣ�� B.ʹ��ǰ����ʱ���� ������ţ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com