往100克24.5% 的硫酸溶液中加入25.6克碳酸钠和硫酸钠的混合物,充分反应后再加入33.2克12%的烧碱溶液,恰好跟剩余硫酸完全中和.计算最后所得溶液溶质的质量分数.
解:烧碱中和的硫酸的质量是x,生成硫酸钠质量是y,
2NaOH+H
2SO
4=Na
2SO
4+2H
2O
80 98 142
33.2×12% X×24.5% Y
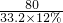
=
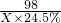
=
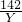
x=19.92克,y=7.1克,
和碳酸钠反应的硫酸就是100-19.92=80.08克,
设碳酸钠是m,生成硫酸钠是n,生成二氧化碳是c
Na
2CO
3+H
2SO
4 =Na
2SO
4+2H
2O+CO
2↑
106 98 142 44
m 80.08×24.5% n c

=
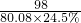
=

=
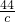
m=21.2g,n=28.4g,c=8.8克,
混合物中的硫酸钠是25.6-21.2=4.4克,所以硫酸钠的质量是28.4+4.4+7.1=39.9克,
根据质量守恒定律,可知参加反应的反应物质的质量等于生成物的质量,
所以反应后溶液质量是100+25.6+33.2-8.8=150克,
所以溶质质量分数为:
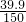
×100%=26.6%,
答:溶液溶质的质量分数26.6%.
分析:根据烧碱的质量计算出反应的硫酸的质量,然后再算出和碳酸钠反应的硫酸的质量,找出反应后溶质质量和溶液质量进行计算.
点评:解这类题的关键是找出溶质质量和溶液质量,注意分析溶质包括哪几部分.

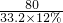 =
=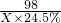 =
=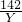
 =
=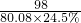 =
= =
=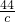
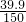 ×100%=26.6%,
×100%=26.6%,

 53随堂测系列答案
53随堂测系列答案