
科目: 来源:江苏省模拟题 题型:实验题
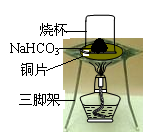

查看答案和解析>>
科目: 来源:吉林省模拟题 题型:实验题
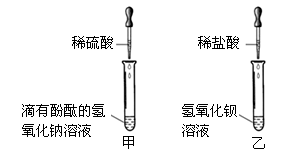
查看答案和解析>>
科目: 来源:江苏模拟题 题型:实验题

查看答案和解析>>
科目: 来源:专项题 题型:实验题
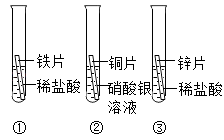


查看答案和解析>>
科目: 来源:专项题 题型:实验题
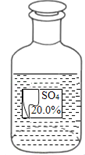
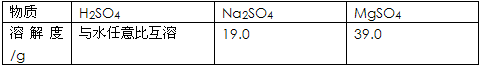

查看答案和解析>>
科目: 来源:专项题 题型:实验题
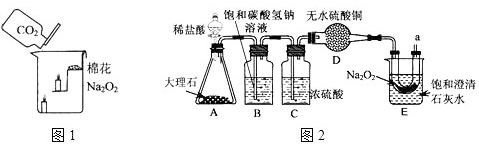
查看答案和解析>>
科目: 来源:专项题 题型:实验题
| 下面是某兴趣小组同学做的3个小实验.根据实验内容回答下列问题. | ||||||||||||||||
|
查看答案和解析>>
科目: 来源:专项题 题型:实验题
查看答案和解析>>
科目: 来源:专项题 题型:实验题

查看答案和解析>>
科目: 来源:北京市模拟题 题型:实验题
| 用下面的装置将一定量的CO2和CO的混合气体进行分离和干燥。图中的a、b、c、d均为活塞,可以控制气体的通过和液体的加入,实验前活塞均已关闭。请选择适宜的试剂完成上述实验。 |
 |
| 供选用的试剂有:①稀硫酸②浓硫酸③氢氧化钠溶液④澄清的石灰水(试剂均足量) 实验分以下两步进行: (1)关闭b、c,打开a、d,则甲中发生反应的化学方程式为_______________,丙中试剂为_______ (填数字序号)。若乙装置中的现象是__________ ,说明甲装置中反应是充分的。 此步实验后收集到的气体是____________。 (2)在甲装置的分液漏 斗中加入试剂①,然后_________________________,即可收集到另一种气体。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com