
科目: 来源: 题型:
【题目】已知金属钻(Co)的活动性与铁相似,请预测氯化钻(CoCl2)的化学性质,说明预测的依据,并设计实验验证。经查阅资料,钻的化合物相关性质如下:
物质 | CoO | Co(OH)2 | CoCl2 | CoSO4 | Co(NO3)2 | CoCO3 |
在水中溶的溶解性 | 难溶于水的灰绿色固体 | 难溶于水的粉红色固体 | 易溶于水形成粉红色溶液 | 易溶于水形成粉红色溶液 | 易溶于水形成粉红色溶液 | 难溶于水的粉红色固体 |
限选试剂:CoCl2溶液、(NH4)2CO3溶液、Na2SO4溶液、AgNO3溶液、NaOH溶液、稀硫酸、镁条、铜片。
预测 | 预测的依据 | 验证预测的实验操作与预期现象 |
①能够与含Ag+的 可溶性盐反应 | CoCl2溶液中含Cl-, AgCl难溶于水。 | 取少量CoCl2溶液于试管中,__________,如果观察到_________________,则预测成立。 |
②能够与________ (填物质类别)反应 | ______________ | 取少量CoCl2溶液于试管中,__________,如果观察到_________________,则预测成立。 |
③能够与________ (填物质类别)反应 | ______________ | 取少量CoCl2溶液于试管中,__________,如果观察到_________________,则预测成立。 |
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室配制饱和澄清石灰水和质量分数为10%的氢氧化钠溶液,并进行有关实验。
下表是20℃时部分物质的溶解度数据。
物质 | Ca(OH)2 | NaOH | CaCO3 | Ca(HCO3)2 | Na2CO3 | NaHCO3 |
溶解度/g | 0.16 | 109 | 0.0065 | 16.6 | 21.8 | 9.6 |
(1)配制溶液。其中配制100g10%氢氧化钠溶液的基本步骤是:
称取氢氧化钠固体—量取水—溶解—装瓶贴标签。

①称取氢氧化钠固体的质量_____________g。
②已知水的密度为1g/cm3,用100mL量筒量取所需的水,_______画出水的液面。
③装瓶后贴标签,在标签上填写:_______________________________。
(2)进行性质探究实验,20℃时,根据数据回答下列问题:
①向饱和澄清石灰水中通入CO2直至过量,先生成CaCO3,再转化为Ca(HCO3)2,可观察到的现象是________________________________。
②向10%氢氧化钠溶液中通入CO2直至过量,先生成Na2CO3,再转化为NaHCO3,可观察到的现象是_______________________________________________________。
③理论上吸收4.4gCO2,需饱和澄清石灰水的质量至少为___________g,或需10%氢氧化钠溶液的质量至少为__________g。(计算结果精确到个位)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是实验室制取CO2及进行性质实验的部分装置。
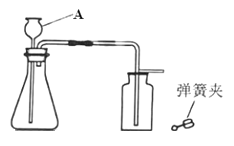
(1)CaCO3固体与稀盐酸反应生成CO2气体的化学方程式是________________。
(2)检验装置气密性,按图连接装置,先__________________________,再加水至A下端形成一段水柱,静置,若观察到_______________________,说明气密性良好。
(3)加入药品。添加块状CaCO3固体时,为避免打破锥形瓶,应将锥形瓶______________,再放入固体。添加盐酸时,将稀盐酸从_______________(填仪器A的名称)倒入锥形瓶至_________________________。
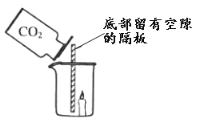
(4)如图所示,向放置有燃着的蜡烛的烧杯中倒入CO2,观察到的现象是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】稀土金属因其独特的性能而被誉为“新材料之母”。稀土金属钇的氧化物(Y2O3)广泛应用于航空航天涂层材料,其颗粒大小决定了产品的质量。利用富钇稀土(含Y2O3约70%,含Fe2O3、CuO、SiO2等约30%)生产大颗粒氧化钇的种工艺如下:
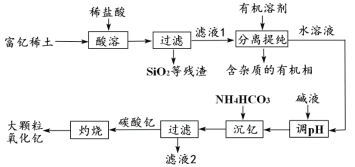
(1)氧化钇(Y2O3)中,Y元素的化合价为____________。
(2)“酸溶”过程中,氧化钇与盐酸反应的化学方程式是______________________________。
(3)“分离提纯”是为了除去滤液1中的_____________________________(填化学式)。
(4)“调pH”时加入碱液使溶液的pH_____________(填“增大”或“减小”)。
(5)碳酸钇灼烧分解的化学方程式是_______________________________________。
(6)为了获得大颗粒氧化钇,某小组研究了条件对产品直径的影响,相关数据如下(D50表示颗粒直径):
实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
沉淀反应温度/℃ | 60 | 80 | 85 | 93 | 93 | 93 |
料液浓度Kg/L | 30 | 30 | 30 | 30 | 40 | 40 |
灼烧温度/℃ | 1100 | 1100 | 1100 | 1100 | 1100 | 1400 |
氧化钇D50/um | 6.00 | 21.65 | 35.99 | 38.56 | 35.99 | 61.54 |
分析上表数据,其他条件不变时,若将灼烧温度均升高至1400℃,预期所得氧化钇D50最大的是____________(填实验编号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年是国际元素周期表年。俄国化学家门捷列夫在公布元素周期表时,就预言了当时还未发现的相对原子质最约为68的元素的存在,且性质与铝相似,称为“类铝”。如图是元素周期表中“类铝”元素镓的相关信息,请同答下列问题:
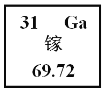
(1)镓原子核外电子数为______________。
(2)金属镓与稀硫酸反应,产物中Ga的化合价为+3,反应的化学方程式是________________________________________。
(3)高纯氧化镓广泛用于生产半导体材料,其一种制备方法如下:
步骤I:向含有硫酸的硫酸镓溶液中通入氨气(NH3),冷却,生成Ga(NH4)(SO4)2固体。
步骤II:在一定条件下灼烧Ga(NH4)(SO4)2固体,制得高纯氧化镓。
①Ga(NH4)(SO4)2中含有的带电的原子团(根)是___________________(填化学符号)
②步骤I反应的化学方程式是____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有一包白色固体样品,可能含有NaOH、Na2CO3、K2SO4、BaCl2中的一种或几种,为确定其组成,进行如下实验:
步骤I:取少量样品于烧杯中,加足量水,充分搅拌,静置,有固体剩余。
步骤II:取步骤I所得上层清液于试管中,滴入几滴酚酞溶液,溶液变红色;再滴入过量稀盐酸,无气泡产生,红色逐渐褪去,得到无色溶液。
步骤III:取步骤II所得溶液于试管中,滴入过量Ba(NO3)2溶液,无明显现象。
根据上述实验,回答下列问题:
(1)步骤II中溶液的红色褪去,发生反应的化学方程式是_________________________。
(2)分析上述实验过程,关于样品的组成,可以得到的结论是____________________。
(3)若要进一步确定样品的组成,还需进行的实验操作是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化氢(HCl)是极易溶于水的无色气体,其水溶液叫盐酸。

HCl气体 盐酸
(1)在充满HCl气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象;再滴入水,现象是___________________________________________________。
(2)向盛有NaHCO3粉末的试管中通入HCl气体,无明显现象;停止通气,再加入少量水,现象是_____________________,发生反应的化学方程式是___________________。
(3)画出HCl气体和盐酸的微观粒子组成示意图,并进行必要的标注_______________(水分子不用画出)。
查看答案和解析>>
科目: 来源: 题型:
【题目】地球大气中存在氧气(O2)和臭氧(O3)两种含氧元素的单质,其中臭氧氧主要存在于15000-30000米的高空,能减弱高能量紫外线对地球表面的辐射。
(1)O3表示一个_____________(填“原子”、“分子”或“离子”)
(2)高空中可发生转化:  ,该变化属于_______(填“物理”或“化学”)变化。
,该变化属于_______(填“物理”或“化学”)变化。
(3)镁在氧气中燃烧的化学方程式是____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】从地沟油中提炼生物柴油是垃圾资源化的方法之一。生物柴油主要成分是硬脂酸甲酯(C19H38O2),下列有关硬脂酸甲酯的说法正确的是
A. C、H、O三种元素的质量比为19:38:2
B. 相对分子质量为(12×19+1×38+16×2)
C. C、H、O三种原子的个数比为12:1:16
D. 氧元素的质量分数为![]() ×100%
×100%
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是
编号 | ① | ② | ③ | ④ |
水的质量/g | 50 | 50 | 50 | 50 |
加入固体质量/g | 5 | 10 | 15 | 20 |
现象 | 固体完全溶解 | 固体完全溶解 | 剩余少量固体 | 剩余较多固体 |
A. 实验①所得溶液质量分数为10%
B. 实验说明25℃时该物质的溶解度是20g
C. 实验③④所得溶液质量分数相同
D. 实验④所得溶液中含溶质20g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com