
科目: 来源: 题型:
【题目】高温煅烧碳酸钙可制得氧化钙,煅烧一定量碳酸钙一段时间后,测得剩余固体中钙元素与碳元素的质量比为40:9.则已分解的碳酸钙占原碳酸钙的质量分数为( )
A. 25%B. 40%C. 50%D. 75%
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点,根据图中已给信息判断下列说法错误的是( )
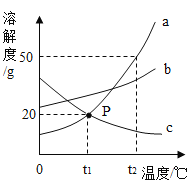
A. P点的含义是t1℃时,a与c的溶解度相等
B. t2℃时,a、b、c三种物质溶解度由小到大顺序为c b a
C. 将t2℃时a、b两种饱和溶液降温到t1℃时,析出晶体的质量a大于b
D. 将t1℃时,a、c两种物质饱和溶液的温度升高到t2℃时,所得两种溶液的质量分数a大于c
查看答案和解析>>
科目: 来源: 题型:
【题目】“土卫六”是土星最大的一颗卫星,最近科学家发现它表面遍布“湖海河流”,这“湖海河流”中液体并非水,而是液态甲烷和液态乙烷,如图为乙烷分子模型,下列有关叙述正确的是( )
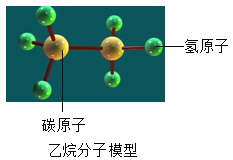
A. 乙烷和甲烷都是由碳、氢原子构成的化合物
B. 乙烷中碳元素的质量分数为60%
C. 每个乙烷分子中有18个质子
D. 乙烷分子中碳、氢元素的质量比是1 :3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学方程式符合题意且书写和所属基本反应类型均正确的是( )
A. 不能用铁器盛放硫酸铜溶液的原因:Fe+CuSO4=FeSO4+Cu 置换反应
B. 铝耐腐蚀的原因:4Al+3O2=Al2O3 氧化反应
C. 工业上以赤铁矿为原料冶炼生铁:2Fe2O3+3C![]() 4Fe+ 3CO2↑ 还原反应
4Fe+ 3CO2↑ 还原反应
D. 电解水产生氢气和氧气:2H2O![]() 2H2↑+ O2 ↑ 分解反应
2H2↑+ O2 ↑ 分解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】9月16日我校举办了声势浩大的秋季运动会,在欢乐轻松的氛围中发扬体育精神。田径比赛时发令员使用的发令枪如图所示,下列有关说法不正确的是( )

A. 发令枪使用的无缝钢管是纯铁制作
B. 计时员看到发令枪冒烟开始计时
C. 发令枪子弹弹壳采用的黄铜是铜锌合金
D. 使用后的发令枪要及时清理擦净污垢避免锈蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是铁及其化合物的实验探究,请回答相关问题:
(问题Ⅰ)
(1)以赤铁矿为原料冶炼铁的化学反应方程式为____。
(2)将Fe粉溶于稀H2SO4的化学方程式是____,此反应属于____(填基本反应类型)。用点燃法检验生成的H2前必须____。向上述反应后的溶液中滴加NaOH溶液,生成白色Fe(OH)2沉淀,随后沉淀变为灰绿色,白色沉淀变为灰绿色的原因之一是部分Fe(OH)2在湿润的空气中生成Fe(OH)3,其反应的化学方程式____。
(问题Ⅱ)
灰绿色固体的热分解实验。过滤、洗涤、低温干燥得到灰绿色固体,其组成为2FeSO42Fe(OH )2Fe2O3[相对分子质量为644]。兴趣小组称取此灰绿色固体6.44g,在科研人员的指导下用下图装置进行热分解实验。
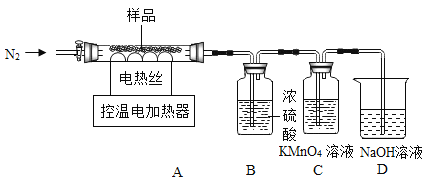
(查阅资料)①Fe(OH)2在150℃~200℃时完全分解为FeO;
②FeSO4在450℃~500℃时完全分解为Fe2O3;
③2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
④浓硫酸只能吸收SO3和H2O。
⑤SO2能使KMnO4溶液褪色
(1)加热前后及过程中均通入N2,加热前通N2的目的是_______。
(2)控制温度在不同的范围对A中样品加热,测得剩余固体质量随温度的变化如图所示。

①当加热到t1℃时,装置C中的溶液褪色,则通入到装置C中的气体为____。(填“化学式”)
②图中E点对应的ml=_______。
③图中F点对应物质中Fe2O3的质量为_______g。
④科研人员将F点所得剩余固体隔绝空气,在密闭容器中加热到1400℃,得到纯净的磁性Fe3O4。已知加热过程中发生两个反应,且反应前后固体总质量不变。请写出其中一个反应的化学方程式_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定某市售CaCO3药品中CaCO3的质量分数(杂质为SiO2,与稀HCl不反应),某同学的方法是:将样品与稀盐酸反应,测定反应后生成的CO2质量,再根据CO2的质量求出样品中CaCO3的质量,从而计算出样品中CaCO3的质量分数。为测定生成CO2的质量,他设计了如图的实验方案(已知;无水氯化钙是常见的干燥剂):
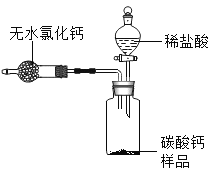
(1)按图组装好装置。检查装置气密性后.在分液漏斗中加入过量稀HCl,并在干燥管中加人适量无水氯化钙固体,称得装置和药品的总质量为564.57g;
(2)在广口瓶中加入CaCO3样品,称得装置和药品的总质最为574.57g;
(3)旋紧橡皮塞,打开分液漏斗旋塞,向广口瓶中滴加稀HCl,使样品与稀HCl完全反应;
(4)反应结束后,称得装置及装置内所有物质的总质量为570.57g。请根据上述实验回答下列问题:
①该方案测得样品中CaCO3的质量分数是_____?(写出解题过程,计算结果精确到0.1%)
②该实验中用稀HCl与CaCO3样品反应,而不用浓HCl与CaCO3样品反应,其原因是_____。实验中无水氯化钙的作用是_____,若实验中不用无水氯化钙,则测得样品中CaCO3的质量分数与上述实验计算结果相比_______(选填“偏小”或“不变”或“偏大”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】请你参与实验室配制一定溶质质量分数的硝酸钾溶液的实验,并进行实验过程的探究:
(1)计算:配制50g质量分数为10%的硝酸钾溶液,所需硝酸钾质量为______g,所需蒸馏水的体积为______mL(水的密度约为1g/mL)。
(2)称量:分别在天平左右两盘放上纸片,调节平衡后,应______(填字母序号)。
A先在托盘上放置所需的砝码,再添加硝酸钾直至天平平衡
B先添加所需的硝酸钾,再添加砝码到所在的托盘直至天平平衡
(探究一):在称量过程中,某同学的称量操作如图所示,你认为该操作对本次实验的数据处理的正确性______(填“有”或“没有”)影响,理由是______。
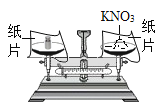
(3)量取:准确量取所需蒸馏水要用到的仪器是____(“少写”或“多写”均不得分)。
(4)溶解:将称量好的硝酸钾和蒸馏水混合溶解。
(探究二):20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液.从表中找出计算所需的密度数据为:______g/mL。
温度℃ 质量分数% | 20 | 40 | 60 |
4 | 1.023 | 1.016 | 1.007 |
10 | 1.063 | 1.054 | 1.044 |
(探究三):已知硝酸钾在部分不同温度时的溶解度如下表
温度/℃ | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 31.6 | 63.9 | 110 | 169 | 246 |
(5)20℃时25 g硝酸钾溶解在50 g水中,所得溶液为______溶液(填“饱和”或“不饱和”),其溶质质量分数为______。
(6span>)将80℃时269g的硝酸钾饱和溶液降温至60℃时(不考虑水分蒸发),所析出晶体的质量是___g。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学语言包括文字、符号语言、化学方程式等。
(1)规范书写下列化学符号(不规范不得分):
① 空气中含量最多的元素______;
② 钾离子_______;
③ 食盐中的阴离子_______;
④ 人体中含量最多的金属元素______;
⑤ 氯化镁中镁元素显+2价_______;
⑥ 硝酸根离子_______。
(2)写出下列反应的化学方程式:
①久置的石灰水瓶壁会形成一层白膜_______;
②加热“铜绿”__________;
③电解氧化铝_______;
④ CH4和CO2反应生成CO和H2_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com