
科目: 来源: 题型:
【题目】下图是实验室制备气体的部分装置。
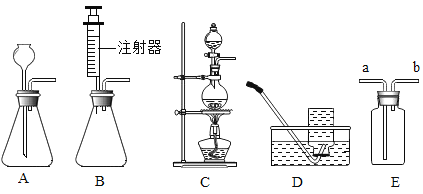
(1)上图装置可以制取不同气体,请完成下表空格。
反应物和反应条件 | 制取的气体 | 发生装置(填字母) | 收集装置(填字母) |
①H2O2溶液和MnO2固体,常温 | _____ | A或B | _____或E |
②亚硫酸钠(Na2SO3)固体和浓硫酸,常温 | SO2 | _____ | E |
③甲酸(HCOOH)和浓硫酸,加热 | CO | _____ | D |
(2)用A装置制取O2时,反应的化学方程式为_____,若要得到干燥的O2,所选择装置的连接顺序为:A→_____→E(填字母序号)。
(3)用E装置收集SO2时,气体应由(填“a”或“b”)_____端进入。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸氢铵(NH4HCO3),俗称“碳铵”,是农村常用的氮肥。NH4HCO3可溶于水:受热容易分解,生成三种物质,经检测,这三种物质性质如下:
生成物 | 相关性质 |
生成物(一) | 无色无味的液体,常用作溶剂 |
生成物(二) | 能使澄清石灰水变浑浊的气体。 |
生成物(三) | 有刺激性气味的气体,水溶液呈碱性。 |
(1)请写出碳酸氢铵受热分解的化学方程式:_____。
(2)请预测碳酸氢铵的化学性质,说明预测的依据,并设计实验验证。
限选试剂是:碳酸氢铵粉末、熟石灰、食盐、稀硫酸、紫色石蕊溶液、炭粉、镁条、氧化铜。
预测 | 预测的依据 | 验证预测的实验操作与预期现象 |
①能够与酸类反应 | 碳酸氢铵组成里有碳酸氢根离子 | 取少量碳酸氢铵粉末于试管中,加入足量的_____,如果观察到_____,则预测成立。 |
②能够与_____(填物质类别)反应 | _____ | 取少量碳酸氢铵粉末_____。如果_____,则预测成立。 |
查看答案和解析>>
科目: 来源: 题型:
【题目】具备基本的化学实验技能是学习化学和进行探究活动的基础和保证。
(1)下图为粗盐提纯实验中的三个主要操作,请回答:
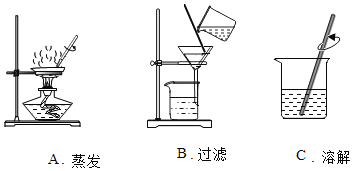
①三个操作均需要用到的一种玻璃仪器的名称是_____。
②粗盐提纯过程中正确的实验步骤顺序是_____。(填字母序号)
③当A中出现_____时,停止加热。
(2)小君用溶解硫酸铜固体的方法配制100g8%硫酸铜溶液,具体步骤为:
①计算。需要硫酸铜固体的质量为_____g。
②称量。称量过程中,若发现天平指针偏右,此时应该(填字母)_____,至指针指向标尺中央。
A 调节游码和砝码 B 调节平衡螺母 C 减少硫酸铜固体 D 增加硫酸铜固体
③溶解。
④装瓶,贴标签。
(3)小东用溶液稀释的办法配制100g8%硫酸铜溶液,需要20%的硫酸铜溶液(密度为1.16g/mL)_____mL(精确到0.1)。
查看答案和解析>>
科目: 来源: 题型:
【题目】向Ba(OH)2溶液中滴入Na2CO3溶液至恰好完全反应,
(1)化学方程式是_____。
(2)可以观察到的实验现象是_____。
(3)如图表示该反应前后溶液中存在的主要离子,写出每种图形代表的离子。(填离子符号):
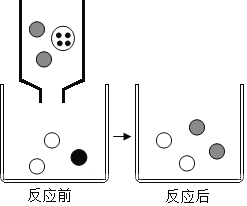
![]() _____;
_____;![]() _____。
_____。
(4)下列物质中能与Ba(OH)2溶液反应产生沉淀的是_____和_____。(双项选择)
A NaNO3 B HCl C MgCl2 D (NH4)2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯铊(Tl)及其合金可做半导体材料。现有5种含铊元素的物质:Tl、Tl2O、Tl2O3、TlOH、Tl2SO4。其中硫酸亚铊(Tl2SO4)溶液为无色,氢氧化亚铊(TlOH)溶液显黄色。请回答下列问题:
(1)Tl2O3读作_____。
(2)在加热条件下,氧化亚铊(Tl2O)与氢气反应生成铊和水,该反应的化学方程式为_____。
(3)取少量无色硫酸亚铊溶液于试管中,再滴加适量氢氧化钡溶液,充分振荡,静置,观察到的实验现象是______。
(4)已知Fe、Tl、Cu的金属活动性由强至弱的顺序为:Fe>Tl>(H)>Cu,以下说法正确的是____。
A 将金属Tl伸入稀硫酸中,金属表面有气泡冒出
B 将铜丝伸入Tl2SO4溶液中,铜丝表面附着一层固体
C 把锌伸入TlCl溶液中,可发生如下反应:Zn+2TlCl![]() 2Tl+ ZnCl2
2Tl+ ZnCl2
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是甲、乙两种固体物质在水中的溶解度曲线。下列说法不正确的是( )
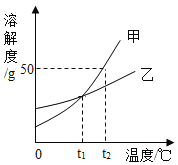
A.t1℃时,甲、乙两种物质的溶解度相等
B.t2℃时,甲的饱和溶液中溶质的质量分数为40%
C.质量相同的甲、乙饱和溶液,由t2℃降温到t1℃,甲比乙析出晶体的质量多
D.t2℃时,将20g甲物质加入50g水中,充分溶解后溶液的质量为70g
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙、丁四种物质在反应前后的质量关系如图所示下列有关说法不正确的是( )
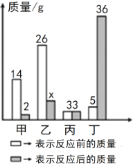
A. 参加反应的甲和乙质量比为14﹕26
B. 丙可能是该反应的催化剂
C. 丁一定是生成物
D. x的值是7
查看答案和解析>>
科目: 来源: 题型:
【题目】下列应用的原理(用化学方程式表示)及基本反应类型均正确的是( )
A. 用赤铁矿高炉炼铁:Fe2O3+3CO![]() 2Fe+ 3CO2 置换反应
2Fe+ 3CO2 置换反应
B. 用NaOH检测溶液中的FeCl3:3NaOH+ FeCl3== Fe(OH)3↓+3NaCl 复分解反应
C. 加热混有二氧化锰的氯酸钾制取氧气2KClO3![]() 2KCl+3O2↑ 化合反应
2KCl+3O2↑ 化合反应
D. 用木炭测定空气中氧气含量:C+O2![]() CO2 分解反应
CO2 分解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】为了测定铁粉样品中铁的质量分数(杂质不含铁元素,不溶于水,也不与其它物质发生反应),进行了如下实验,请回答下列问题:
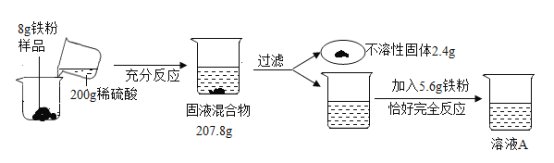
(1)上述实验过程中发生反应的化学方程式为_________________。
(2)根据已知条件,列出求解加入 5.6g 铁粉时参加反应的稀硫酸中溶质质量(x)的比例式_________________。
(3)此铁粉样品中铁的质量分数为_________。
(4)用 98%的浓硫酸配制 200g 上述稀硫酸,所需浓硫酸的质量为__________________________。
(5)若向反应后的溶液 A 中加入 93.2g 水,所得溶液中溶质的质量分数为______________________。
(6)用 120kg 纯度为 80%的赤铁矿石,不计炼制过程中的损失,能生产出题中上述铁粉样品的质量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】勇往直前学习小组的同学们在实验室中探究“碱的化学性质”,请你参与!
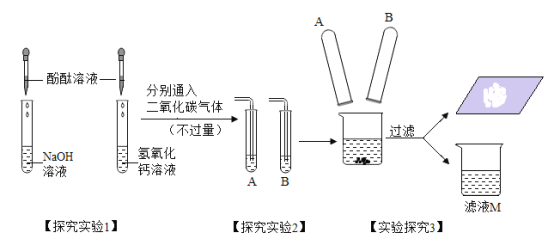
(探究实验 1)实验中观察到 A、B 试管内出现的现象为______________________。
(探究实验 2)B 试管中发生反应的化学方程式为_____________________________, 此反应在生活中的一个应用是______________________________________________。
结合上述实验及你所了解的氢氧化钠的性质,分析氢氧化钠必须密封保存的原因_______________。
(探究实验 3)同学们对所得到的滤液 M 中的离子组成展开探究:
(提出问题)滤液 M 中含有哪些离子?
(猜想假设)小冰的猜想:Na +、OH -
小城的猜想:Na +、OH -、CO3 2-
小美的猜想:Na +、CO3 2-
小丽的猜想: _______(填离子符号)
(设计实验)为了验证自己的猜想是正确的,小城取适量滤液 M 于试管中,向其中滴加过量氯化钙溶液,观察到_____________,则可以证明自己的猜想是正确的。
(拓展延伸)为科学处理剩余的滤液 M,可以进行的操作是____________________________,就可以排放了。 同学们成功地完成了探究,在探究过程中体现了他们严谨认真的科学精神,对废液的合理处理更体现了他们高度的社会责任感。这是非常值得我们学习的。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com