
科目: 来源: 题型:
【题目】下列实验设计不能达到实验目的是( )
编号 | A | B | C | D |
实验设计 |
|
|
|
|
实验 目的 | 探究同种物质在不同 溶剂中的溶解性 | 探究物质燃烧的 条件 | 探究CO2与NaOH 发生反应 | 探究呼出气体与空气 中氧气含量的不同 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案可行的是( )
A.![]() 溶液
溶液![]() 加入过量的铁粉,过滤
加入过量的铁粉,过滤
B.![]() 固体
固体![]() 加水充分溶解,过滤,蒸发结晶
加水充分溶解,过滤,蒸发结晶
C.![]() 气体
气体![]() 依次通入浓硫酸和足量的氢氧化钠溶液
依次通入浓硫酸和足量的氢氧化钠溶液
D.KCl溶液![]() 滴加碳酸钠溶液至恰好完全反应,过滤
滴加碳酸钠溶液至恰好完全反应,过滤
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用如图装置制取、干燥、收集气体正确的是( )
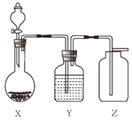
A | B | C | D | |
X | 过氧化氢溶液与 二氧化锰 | 锌粒与 稀硫酸 | 大理石与 稀盐酸 | 氯酸钾与 二氧化锰 |
Y | 浓硫酸 | 浓硫酸 | 氢氧化钠 | 浓硫酸 |
Z | O2 | H2 | CO2 | O2 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】学习氢氧化钠的化学性质后,小明做如下实验:(提示:氯化镁溶液为无色,不能使酚酞试液变红)
实验 | 实验操作 | 实验现象或预期现象 | 结论或解释 |
Ⅰ |
| 现象:______________ | 二氧化碳与氢氧化钠发生化学反应,该反应 方程式为__________ |
Ⅱ |
| 溶液由无色变为红色 | 结论:_____________________________ |
Ⅲ |
| 加入稀盐酸后,未观察到明显现象;滴入酚酞后,溶液变红色。 | 盐酸与氢氧化钠未发生化学反应 |
Ⅳ |
| 有白色沉淀生成 | 生成沉淀的原因(用化学方程式解释) _________________ |
Ⅴ | 1.将II、III、IV三支试管中的物质倒入一个洁净的烧杯中 | 烧杯中出现白色沉淀,静置,上层清液无色 | 上层清液中溶质的成分为 __________ (除指示剂外) |
2.取少量上层清液于试管中,滴入_____溶液,可探知该清液中溶质成分 | 可能出现的现象为:________________ |
(1)请补充表格.①~⑦的内容。
(2)小军认为小明实验I操作设计不足以说明二氧化碳与氢氧化钠发生化学反应,应做的改进是_____
(3)小亮认为小明实验III
(4)小琳同学提出,实验III如果不用酚酞指示剂,可向盐酸和氢氧化钠混合后的溶液中加入某些物质,根据相应的现象来判断反应是否发生。下列分析正确的有_________
A 加入Na2CO3溶液,如果不产生气泡,能证明反应发生。
B 加入CuSO4溶液,如果不产生蓝色沉淀,能证明反应发生。
C 加入紫色石蕊溶液,如果溶液呈紫色,能证明反应发生。
查看答案和解析>>
科目: 来源: 题型:
【题目】胆矾(CuSO4·5H2O)是一种重要的含铜化合物。胆矾溶于水得硫酸铜溶液。可用孔雀石为原料制取胆矾,部分工艺流程如如图。孔雀石主要成分为Cu2(OH)2CO3,还含有少量SiO2(难溶于水、不与稀硫酸反应)、Fe2O3等杂质,Cu2(OH)2CO3难溶于水,与稀硫酸反应无沉淀生成。请回答:
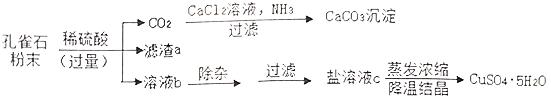
(1)在CO2生成CaCO3的过程中,发生反应:CO2+CaC12+2NH3+H2O=CaCO3↓+2X,X的名称为__
(2)滤渣a的化学式为_______________
(3)写出Fe2O3与稀硫酸反应的化学方程式:_______________________________________
(4)溶液b中的溶质有(写化学式):H2SO4、____________、__________________
(5)盐溶液c的颜色为__________,实验室蒸发溶液时用到的玻璃仪器有_____________(写出两种)。
(6)农业上可用硫酸铜溶液和熟石灰配置波尔多液,写出反应的化学方程式:___________________; 该反应的基本反应类型为_________________
(7)工业上可用电解硫酸铜的方法得到铜,其方程式为:2CuSO4+2H2O=2Cu+O2↑+2H2SO4,电解产生64kg铜,能生成氧气________kg
查看答案和解析>>
科目: 来源: 题型:
【题目】在食盐中加入适量的碘酸钾(KIO3),可预防碘缺乏病。
(1)人类膳食中缺碘易患_________
A 甲状腺肿大 B 贫血 C 骨质疏松症 D 软骨病
(2)某兴趣小组的同学,欲检测一袋食盐是否为加碘食盐,他们查阅资料得知,加碘食盐中的KIO3在酸性条件下能与KI溶液发生反应,生成碘(I2),淀粉遇I2变蓝色。现提供下列试剂和生活中常见的物质:
①KI溶液;②纯碱:③米汤;④白糖;⑤白酒:⑥白醋,该小组同学进行实验必须选用的试剂和物质是_______________
A ①③④ B ①③⑥ C ②④⑥ D ①④⑤
(3)该小组同学仔细阅读加碘食盐包装袋上的说明后,提出问题并与其他同学讨论,继续进行探究。
问题一:食盐是比较稳定的,而说明中强调“防热”,是否因为受热会造成碘的损失?
(实验一)探究温度对碘损失率的影响
老师指导他们将一定浓度的碘酸钾溶液分成5等份,在不同温度下加热十分钟后,用硫代硫酸
钠标准溶液测定碘酸钾溶液的浓度,计算碘损失率并记录如表:
温度 | 30℃水浴 | 50℃水浴 | 80℃水浴 | 100℃水浴 | 煮沸 |
碘损失率(%) | 0 | 0.3 | 0.67 | 1 | 5.56 |
①分析上表可得出的结论是_____________________________________
②人们常说:“炒菜时要后放碘盐,以免碘的损失。”这里的“碘”指的是____(填“碘单质”、“碘 元素”或“碘原子”)。
问题二:炒菜时加醋对碘的损失率是否也有影响?
(实验二)探究酸碱度对碘损失率的影响
③此组对照实验,要控制在加热的时间和温度、碘酸钾溶液的浓度和______均相同,溶液的酸碱度不同的条件下进行。
④实验需要调节溶液的酸碱性,下列物质不能选用的是_______(填字母)。
A 氢氧化钠 B 纯碱粉末 C 食盐晶体 D 稀盐酸
(4)碘酸钾中碘元素的质量分数为______。我国规定,食盐中加碘的含量为每千克食盐含腆0.035克,相当于每千克食盐含碘酸钾_____克。(精确到小数点后二位)
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图所示制取气体的装置,回答下列问题(装置选择用序号填写):
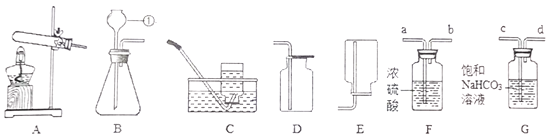
(1)实验仪器①的名称是_____________
(2)用高锰酸钾制取氧气时,选择的发生装置为_____,排空气法收集氧气,应选用的装置是____,验满的方法是__________________________________________________
(3)用大理石和稀盐酸制取二氧化碳时,反应的化学方程式为________________________________
若装置B中反应剧烈,从实验可行性和安全角度考虑,可采取的措施有_________(填序号)。
①用容积较小的锥形瓶 ②将大理石进一步粉碎 ③加热反应物
④降低液体反应物的浓度 ⑤用稀硫酸代替稀盐酸
(4)采用上述方法制取的二氧化碳中常含有氯化氢气体和水蒸气,为获得纯净、干燥的二氧化碳气体,可选用如图所示的F装置和G装置进行除杂和干燥,导管囗连接的正确顺序是:
气体→_____→______→______→______→D(填小写字母),除杂过程中发生反应的化学方程式是________
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题。
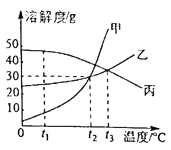
(1)随着温度的变化溶解度变化较大的种物质是__________,这类物质常采取___________的方法从溶液中获得晶体。
(2)t1℃时,甲、乙、丙三物质的溶解度由大到小的顺序是__________________
(3)t2℃时,甲和乙的溶解度__________(填“相等”或“不相等”)。
(4)t2℃时,甲物质的饱和溶液中溶质与溶剂的质量比为__________(写最简比)。
(5)t3℃时,将乙和丙两种物质的饱和溶液降低到t1℃,所得溶液中溶质的质量分数大小关系为:乙____丙(填“>”或“<”或“=”)
查看答案和解析>>
科目: 来源: 题型:
【题目】在宏观、微观和符号之间建立联系是化学学科的特点
(1)在干冰、金刚石、氯化钠三种物质中,由离子构成的物质是______
(2)从微观角度解释一氧化碳和二氧化碳化学性质不同的原因是__________________________
(3)如图是核电荷数为1~18的元素的原子结构示意图等信息,请根据图回答下列问题:

①画出镁离子结构示意图_______________________________
②与氮元素化学性质相似的元素是_________(写化学符号)。
③具有相同原子数和电子数的分子叫等电子体,等电子体具有相似的结构和性质。下列各组微粒中属于等电子体的是_____________
A. NO和O2 B. CO和N2 C. H2O和NH3 D. N2O和CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】化学兴趣小组在实验室发现一瓶氢氧化钠溶液,瓶口有少量白色固体且玻璃瓶塞打不开,这一情况激起了他们浓厚的兴趣,于是展开了如下探究:
[提出问题]瓶口白色固体的成分是什么?
[查找资料]①玻璃中含有二氧化硅(SiO2),试剂瓶身经抛光处理,不易反应,而瓶口和玻璃塞上的磨砂将二氧化硅裸露出来;
②二氧化硅能与氢氧化钠溶液反应, ![]() ;
;
③硅酸钠(Na2SiO3)是种白色固体,有很强的粘合性,可溶于水,溶液呈碱性;硅酸钠溶液能与强酸反应,如:![]() ;硅酸钠溶液能与氯化钙溶液反应:
;硅酸钠溶液能与氯化钙溶液反应:![]() 。
。
[作出猜想]白色固体的成分是:Ⅰ.硅酸钠; Ⅱ.硅酸钠和碳酸钠; Ⅲ.硅酸钠、碳酸钠和氢氧化钠
[实验探究]取一定量白色固体溶于适量水中形成样品溶液,分组进行如下实验并相互评价:
实验操作 | 实验现象 | 结论与评价 | ||
第 1 组 |
滴加足量_______ | 有气泡冒出,且产生白色沉淀 | 同学们认为猜想I______(成立或不成立);写出生成气体的化学方程式_______ | |
第 2 组 | 第一步 |
| 产生白色沉淀 | 第1组同学认为:此步骤还不能准确判断出原固体的成分 |
第二步 |
| ________ | 大家一致认为:猜想Ⅱ成立 | |
[反思交流]
(1)第2组实验第一步中加入过量氯化钙的作用是____________________________。
(2)有同学认为,第2组实验中不能用氢氧化钙溶液代替氯化钙落液,理由是______________________。
(3)氢氧化钠溶液必须密封保存,且试剂瓶只能用_____________塞。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com