
科目: 来源: 题型:
【题目】镍在元素周期表中的信息如下图所示,下列有关镍元素的说法不正确的是
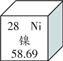
A. 原子序数是28 B. 属于金属元素
C. 原子中的质子数是28 D. 相对原子质量为58.69 g
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列装置图,回答有关问题。
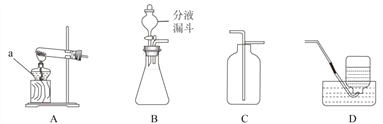
(1)写出装置图中标号仪器的名称:a____。
(2)实验室用高锰酸钾制取氧气,反应的化学方程式是 ___________________________________________________________________ ,可选用的发生装置是___________________(填字母)。
(3)实验室用锌和稀硫酸制取氢气,反应的化学方程式为 ________________________________________ ,
可选用的收集装置是 ___________________(填字母)。若装置 B 中反应剧烈,从实验安全角度考虑,不宜采取的措施有 ___________________(填序号)。
①用容积较小的锥形瓶 ②减慢滴加液体的速度
③加热反应物 ④降低液体反应物的浓度
(4)实验室用溶质质量分数为 5%的过氧化氢溶液制取氧气,若要得到 0.8g 氧气,至少需要过氧化氢溶液的 质量是_________?(写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组对旧铜器上的绿色锈斑产生了探究兴趣。
(一)对绿色锈斑的探究
(查阅资料)①无水硫酸铜为白色粉末,遇水变蓝;②碱石灰是 CaO 和 NaOH 的固体混合物;③绿色锈斑 的主要成分是碱式碳酸铜(Cu2(OH)2CO3),受热易分解。
(探究过程)
实验1:取一定量的碱式碳酸铜放入试管中并加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色 液滴出现。
猜想: (1)从元素守恒角度分析,该黑色固体可能是①碳粉;②氧化铜;③ ___________________。
(2)从元素守恒角度分析,生成的气态物质可能是水和 CO2 的混合气体。
实验 2:取少量实验 1 中的黑色固体物质于试管内,加入足量稀硫酸并加热,观察到 ___________________ , 则猜想②正确。
实验 3:同学们选择如下装置探究反应生成的气体成分。

实验步骤:(1)打开 A 中活塞,通入一段时间的空气;
(2)关闭活塞,连接装置,其连接顺序为 A→_____→______________;
(3)点燃酒精灯,充分加热后,停止加热。
现象与结论:根据实验现象可知,碱式碳酸铜分解还生成了二氧化碳和水。
则 A 中玻璃管内反应的化学方程式为 ________________________________________ ;
B 中反应的化学方程式为 _______________________________________________________ ;
反思与评价:A 装置中 U 形管内碱石灰的作用是 _______________________________________ ;
(二)用锈蚀严重的废铜屑为原料,回收铜
资料 1:Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑
资料 2:回收铜的两种实验方案。

反思与评价:
(1)步骤Ⅱ反应的化学方程式为 ____________________________________ 。
(2)溶液 A 中的主要离子有 ____________________________________(写出离子符号)。
(3)理论上两种方案获得铜的质量比较:方案一 ___________________________方案二(选填“>、=、<”)。
(4)方案二优于方案一的理由是_____________________________________________________________(答一点)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组的同学为探究二氧化碳与氢氧化钠的反应,向一个收集满二氧化碳气体的质地较软的塑料瓶中加入约 1/3 体积的稀氢氧化钠溶液(如图 A),盖好盖子,振荡,观察到塑料瓶变瘪。
(1)小华同学质疑上述实验设计,认为上述实验现象无法证明二氧化碳与氢氧化钠确已反应,该同学质疑的依据是 ________________________ 。
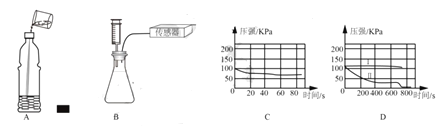
(2)针对小华的质疑,兴趣小组的同学在老师的指导下,设计了如图 B 所示的实验装置,用传感器测量B装置中锥形瓶内压强的变化。
①首先检查 B 装置气密性。图像 C 说明装置气密性良好,该同学进行的操作是_________________________
②在两个相同的锥形瓶中收集满 CO2,通过注射器分别向瓶中注入同体积的水和氢氧化钠溶液,图 D 是实验中同学们用传感器测得的锥形瓶内压强变化情况,其中表示注入氢氧化钠溶液的瓶内压强变化曲线的是____________(填“Ⅰ”或“Ⅱ”)。
(3)为进一步验证二氧化碳与氢氧化钠确实发生了反应,小宁向变瘪的塑料瓶中注入少量稀盐酸,有气泡产 生,塑料瓶又重新鼓起。写出加入盐酸产生气泡的化学方程式___________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】A~H 是初中化学常见的8 种物质,分别由C、 H、O、Cl、Ca中的一种或几种元素组成,已知A、B、C、D是不同类别的物质,C是大理石的主要成分,D、G组成元素相同,E是一种可燃性气体,H常温下是一种气态单质。这些物质之间相互关系如右图所示,图中“—”表示能相互反应,图中“→”表示转化关系。(部分反应物、生成物及反应条件已略去)

(1)C的化学式是______。
(2)A与B反应的化学方程式是__________。F→E反应的化学方程式是_________。
(3)D→G反应的基本反应类型是_______。
(4)H的一种用途是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】水和溶液在生产生活中起着重要的作用。
(1)海水中含量最多的物质是___________________。
(2)下列做法有利于保护水资源的是___(填序号)。
A.大量使用化肥、农药 B.工业废水处理达标后排放
C.使用含磷洗衣粉 D.生活污水直接排放
(3)生活中,一般可用________的方法来使硬水转化为软水。
(4)我国研制出比漂白粉更高效的饮用水消毒剂“ClO2”,完成制取 ClO2 的反应的化学方程式: Cl2 + 2NaClO2=2ClO2 +_________。
(5)KNO3 和 NaCl 的溶解度曲线如图甲,20℃时取 18g KNO3和 18gNaCl 分别放入两只烧杯中,各加入 50mL水(水的密度 1g/mL),充分溶解,现象如图乙所示;升温到 50℃时,现象如图丙所示。请回答下列问题:
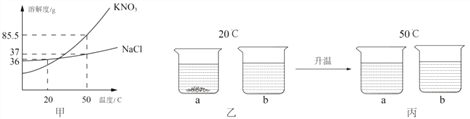
①乙图中,a 烧杯溶液中溶质的质量分数 ___________________b 烧杯溶液中溶质的质量分数(选填“>” “<”或“=”)。
②要使丙图中的 NaCl 溶液恰好变成饱和溶液,需要加入 ___________________ gNaCl 固体。
③除去固体 KNO3中混有的少量 NaCl,实验步骤:先加水加热溶解,再 ___________________ ,然后过滤、洗涤、干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】资源、能源与环境已成为人们日益关注的问题。
(1)化石燃料包括_____、石油和天然气,天然气主要成分充分燃烧的化学方程式是_____。
(2)二氧化硫、一氧化碳是大气污染物。请写出它们的化学式并标出各元素的化合价_____、_____。
(3)下列实验中,对应的现象以及结论都正确的是_____。
选项 | A | B | C | D |
实验 |
|
|
|
|
现象 | 红磷熄灭冷却后,打开弹簧夹,水倒流入集气瓶,约占集气瓶容积的1/5 | 石蕊变红 | 黑色粉末变成红色 | 甲中铁钉生锈,乙、丙中铁钉无明显变化 |
结论 | 氧气约占空气质量的1/5 | 二氧化碳具有酸性 | 一氧化碳具有还原性 | 铁生锈需要与水和氧气同时接触 |
查看答案和解析>>
科目: 来源: 题型:
【题目】从植物中提取的秋水仙碱有润肺止咳功效,其化学式为C22H25NO6。下列说法正确的是
A. 秋水仙碱中氧元素的质量分数约为24% B. 秋水仙碱由54个原子构成
C. 秋水仙碱中碳、氢元素质量比为22∶25 D. 秋水仙碱属于有机高分子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定某敞口放置的氢氧化钠溶液的变质情况。某同学实验并记录如图
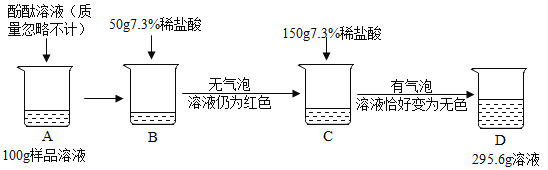
(1)C烧杯溶液中的溶质是________ ;
(2)向D烧杯内加入4.4g水,求所得不饱和溶液中溶质的质量分数?_______(计算结果精确到0.1%)
(3)求原氢氧化钠溶液中变质的氢氧化钠与未变质氢氧化钠的质量比?_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】硅酸钠(Na2SiO3)是我国优先发展的精细化工产品。实验室以5g石英砂粉末(其中SiO2质量分数为96%,其余为不溶于水也不与其他物质反应的杂质)为原料,与一定量NaOH溶液反应制取硅酸钠溶液,反应的方程式为:2NaOH+SiO2Na2SiO3+H2O。充分反应后,过滤,得到硅酸钠溶液20g,将滤渣洗涤、烘干,称量质量为2g。
(1)硅酸钠中钠元素、硅元素的质量比为______________________;
(2)2g滤渣中SiO2的质量质量分数___________;(计算结果精确到0.1%)
(3)求把20g硅酸钠溶液,稀释为质量分数为10%的溶液,求需要加入水的质量_____________;
(4)求原氢氧化钠溶液中溶质的质量分数_____________。(计算结果精确到0.1%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com