
科目: 来源: 题型:
【题目】某固体粉末可能含有碳酸钙、硫酸钠、氯化钠、氯化钡、硫酸铜中的一种或几种。为确定该固体粉末的成分,进行了如下实验:
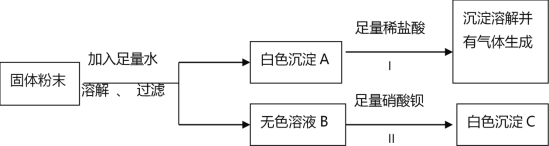
回答下列问题:
(1)反应I的化学方程式为________。
(2)白色沉淀C是______(填化学式)。
(3)原固体粉末中一定不含______(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学对CaH2的制备和性质进行探究。
(阅读资料)①用H2与钙加热制得CaH2②钙遇水立即发生剧烈反应生成一种碱和一种气体
③CaH2要密封保存,遇水反应也生成一种碱和一种气体
(CaH2的制备)设计的制取装置如图所示.
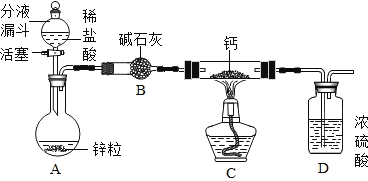
(1)装置D的作用是_____;
(2)制备CaH2实验结束后,取少量产物,小心加入水中,观察有气泡产生,在溶液中滴入石蕊试液后显_____色。该同学据此判断:实验中确有氢化钙生成,其他同学提出结论不一定正确,原因是_____。
(CaH2的性质探究)取少量上述制得的CaH2 样品加入到足量的碳酸钠溶液中,产生大量气泡,过滤,得到滤渣和滤液。经检验滤渣的成分是碳酸钙。该同学进行了如下的探究。
(3)点燃产生的气体,火焰淡蓝色;将燃烧产物通入澄清石灰水中,无现象。则该气体为______(写化学式)。
(4)对滤液中溶质的成分做出如下猜测并进行实验:
猜想一:NaOH
猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3
猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因。________
(实验验证)
实验 | 现象 | 结论 |
实验一:取滤液,向其中滴入少量 Na2CO3溶液 | ______ | 猜想二不成立 |
实验二:另取滤液,向其中加入足量稀盐酸 | ______ | 猜想三成立 |
(定量分析)
(5)取制得的CaH2样品1g(杂质为未反应完的Ca)加入到足量的Na2CO3溶液中,充分反应后,过滤、洗涤、干燥称得CaCO3质量为2.4g,则该样品中CaH2的质量分数为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】请结合下图回答问题。
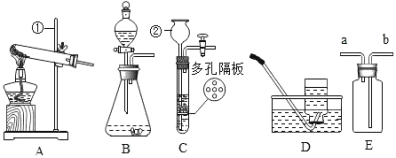
(1)仪器②的名称:_____________。
(2)用高锰酸钾制取氧气,可选用装置_______(选填序号)和装置D组合,反应的化学方程式为_________。
(3)实验室可用装置B或C制H2,C装置相对于B的优点有____,用E装置收集H2,气体应从_____(选填“a”或“b”)端通入。
(4)某些大理石中含少量硫化物,使制得的CO2中混有H2S等气体。欲获取纯净、干燥的CO2,设计实验如下:
查阅资料:I.H2S能与NaOH、CuSO4等物质反应。
Ⅱ.CO2中混有的HC1气体可用饱和NaHCO3溶液吸收。
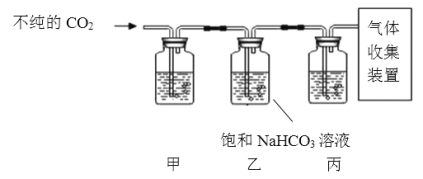
①装置甲中所盛试剂应选用____________(填字母)。
a浓硫酸 b NaOH溶液 c澄清石灰水 d CuSO4溶液
②装置丙的作用是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上炼铁炼钢和轧制钢材的主要流程如图.

已知生铁的含碳量为 2%--4.3%,钢的含碳量为 0.03%--2%。
(1)反应:①Fe2O3+3CO ![]() 2Fe+3CO2 ,②3C + 2Fe2O3
2Fe+3CO2 ,②3C + 2Fe2O3 ![]() 4Fe + 3CO2↑。属于置换反应的是_________ ,用于高炉炼铁的原理是 _________(填序号)
4Fe + 3CO2↑。属于置换反应的是_________ ,用于高炉炼铁的原理是 _________(填序号)
(2)生铁属于 _________ (填“纯净物”或“混合物”),其熔点比纯铁 _________(填“高”或“低”),铁是由 _________ 构成的物质(填“分子”、“原子”或“离子”)。
(3)炉渣中含有硅酸钙(CaSiO3),其中硅元素的化合价是 _________ 。
(4)将钢锭轧成钢板,属于_________(填“物理变化”或“化学变化”) 。
(5)钢铁制品可能会生锈,写出用稀硫酸除锈反应的化学方程式 _____________________ 。
(6)请用一个化学方程式证明铁的活泼性大于铜 __________________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】十九大报告提出:“打好污染防治攻坚战,建设美丽中国”。山西省围绕“控煤、治污、管车、降尘”等领域持续推进大气污染治理。
(1)控煤——煤改气、煤改电,用天然气代替燃煤。请写出天然气燃烧的化学方程式______。
(2)治污—— 禁止燃放烟花爆竹。下列图标中表示禁止燃放鞭炮的是_______。
a. b.
b. c.
c. d.
d.
(3)管车—— 淘汰老旧机动车,投入清洁能源汽车。下列属于清洁能源汽车的是_______。
a.氢能源汽车 b.太阳能汽车 c.燃油汽车
(4)降尘—— 扬尘污染是造成重污染天气的主要原因之一,请写出一种你知道的降尘方法__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】食品工业中碘化钾(KI)可用作营养增补剂。碘化钾是白色固体,在空气中久置会“泛黄”变质。某实验小组对碘化钾变质后的成分及变质的条件进行探究。
I.探究变质后的固体成分
(查阅资料)淀粉溶液遇碘(I2)变蓝。
(进行实验)
实验 1
编号 | ① | ② |
操作及现象 | 加热变质后的 KI 固体,黄色消失, 产生的紫色蒸气使淀粉溶液变蓝。 | 向变质后的 KI 固体中滴加稀盐酸, 产生的气体使澄清石灰水变浑浊。 |
II.探究变质的条件
(猜想与假设)常温下,KI 固体“泛黄”变质可能与 O2、CO2 和水蒸气有关。
(进行实验)
实验 2:利用下图装置和表中所列物质分别进行实验,放置相同时间,现象如下表。
装置 | 编号 | ① | ② | ③ | ④ |
| 试管中的物质 | O2 和 H2O | O2 和 CO2 | H2O 和 CO2 | O2、CO2 和H2O |
固体颜色 | 无明显变化 | 无明显变化 | 无明显变化 | 固体泛黄 |
(解释与结论)
(1)实验 1 中石灰水变浑浊的原因是_________(用化学方程式表示)。
(2)由实验 1 中现象推知,“泛黄”变质后的固体中含有的物质是________。
(3)由实验 2 得出“KI 变质一定与 O2 有关”的结论,依据的两个实验是________(填编号)。
(4)由实验 2 推知,KI“泛黄”变质的条件是_________。
III.依据初步结论,深入探究变质的条件
实验 3:分别取相同浓度的 KI 溶液进行实验,在空气中放置相同时间,现象如下表。
编号 | ① | ② | ③ | ④ | ⑤ |
实验 |
|
|
|
|
|
溶液颜色 | 无色 | 浅黄色 | |||
(5)实验 3 中,观察到③~⑤溶液颜色依次加深,推测其原因是________。
(6)由实验 3 推知,KI 固体久置“泛黄”变质过程中,CO2 起到的作用是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图装置完成 CO 还原 Fe2O3 的实验。缓慢通入一定量的 CO。点燃酒精喷灯,继续通入 CO。一段时间后,当粉末全部变为黑色时,停止通入 CO,熄灭酒精喷灯。

(1)CO 与 Fe2O3 反应的化学方程式是________。
(2)在冷却过程中,为防止管中黑色粉末表面因与空气接触而变为红色,应补充的操作是________。
(3)有同学提出黑色粉末中还可能含有 Fe3O4。资料: Fe3O4 不与 CuSO4 溶液反应。
为验证黑色粉末成分。该同学取少量样品于烧杯中,加过量 CuSO4 溶液,充分反应。证明黑色粉末中含 Fe 和 Fe3O4 的现象是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验小组同学分别向下列试剂中滴加自制紫薯汁,现象记录如下:
| 稀盐酸 | 氢氧化钠溶液 | 蒸馏水 | 白醋 | 草木灰溶液 |
滴加2滴紫薯汁 | 红色 | 绿色 | 紫色 | 红色 | 绿色 |
(1)紫薯汁________(填“能”或“不能”)作酸碱指示剂。
(2)草木灰溶液呈_________ (填“酸性”、“中性”或“碱性”)。
(3)向“蒸馏水中滴加紫薯汁”的目的是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】请从A或B两题中任选一个作答,若两题均作答,按A计分。
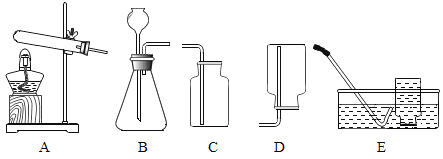
A | B |
(1)实验室用高锰酸钾制取氧气的化学方程式是________。 (2)用装置A、E制取氧气。选用装置E收集氧气的原因是________。 | (1)实验室制取二氧化碳的化学方程式是________ (2)用装置B、C制取二氧化碳。检验二氧化碳已收集满的操作是________。 |
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上制造高纯度 CaO 的主要流程示意图如下:
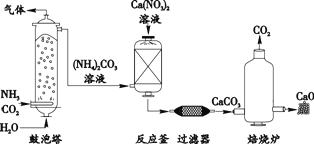
(1)CaCO3 中碳元素的化合价是_________。
(2)反应釜中发生的反应属于复分解反应,其化学方程式是________。
(3)焙烧炉中,CaCO3 在 1000 ℃可分解得到高纯度 CaO。理论上 5 t CaCO3 制出CaO 的质量是________ t。稍冷后,取出 CaO 立即放入干燥器,其原因是________(用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com