
科目: 来源: 题型:
【题目】某纯碱样品中含有少量氯化钠。现称量该样品15.4g放入烧杯中,再向其中加入一定溶质质量分数的稀盐酸至100g时恰好完全反应。此时烧杯内的物质质量为111g。试计算:
(1)碳酸钠中钠元素、碳元素、氧元素的质量比为__________;(化为最简比)
(2)反应后生成的气体质量为_________g;
(3)恰好完全反应时所得溶液中溶质的质量分数________。(计算结果精确到0.1%)
查看答案和解析>>
科目: 来源: 题型:
【题目】小明发现某食品包装袋中有一个小袋,上面标有“成分:生石灰、铁粉;作用:防潮、防氧化”等字样。他想了袋内解粉末是否已失效,取少量粉末在水中充分溶解,滴入无色酚酞发现不变色。通过查阅资料获知,常温下铁在空气中不能反应生成Fe3O4和FeO,于是对粉末成分做出如下猜想:
猜想一:可能是CaCO3和Fe;
猜想二:可能是CaCO3和Fe2O3;
猜想三:可能是_____。
(实验设计)小明设计了如图所示的实验:

(实验与分析)
(1)向A装置中加入稀盐酸,B装置中出现浑浊现象,证明样品中含有CaCO3。
(2)若粉末中含有Fe,装置E中应观察到的现象是_____。
(评价与反思)
上述实验中,如果将E装置去掉,是否还能验证粉末中含有Fe,请说明理由_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】a、b、c三种固体物质的溶解度曲线如图所示,请回答。
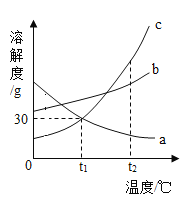
(1)若c中混有少量的b,最好采用_______的方法提纯c。
(2)气体的溶解度随温度变化的情况与______(填“a”、“乙b”或“丙c”)相似。
(3)t2℃时,a、b、c三种物质的溶解度由大到小的顺序是_______。
(4)t1℃时,向盛有15ga物质的烧杯中加入50g水,充分溶解后得到65g溶液。若要增大该溶液的溶质质量分数,可采用的方法是_____。
(5)t2℃时,将a、b、c三种物质的饱和溶液都降温到t1℃,溶液中溶质质量分数由小到大的顺序为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属在日常生活、工农业生产和科学研究方面应用广泛。
(1)铜可用来制作导线,是因为其具有良好的延展性和_____。
(2)天津的解放桥是一座全钢结构可开启的桥梁,它是天津的标志性建筑物之一。
①钢属于_____(填“单质”、“纯净物”或“混合物”)。
②工业上用一氧化碳和赤铁矿炼铁的原理是_____(写化学方程式)。
③建造这座桥大约用了112t铁,理论需要含氧化铁80%的赤铁矿_____t。
(3)为探究铁、铜、银的金属活动性顺序,同学们设计了如图所示的两步实验。
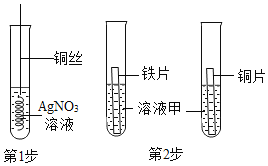
①第1步实验的目的是_____。
②第2步实验中,为了达到实验目的,溶液甲可以是_____(填序号)。
A 稀盐酸 B FeSO4溶液
C CuSO4溶液 D ZnSO4溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】“对比实验”是化学学习中行之有效的思维方法。某化学学习小组的同学在学完相关的化学知识后,走进实验室做了如下几组实验,请你参与并回答下列问题。
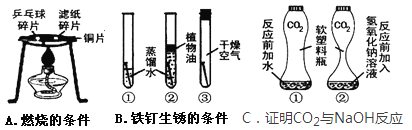
(1)在实验A中,观察到的现象是______________________________________;
(2)在实验B中,试管②中植物油的作用是_________________________;
(3)为了保证实验C得到的结论更可靠,在实验中的要点是:相同的软塑料瓶中充入的二氧化碳体积、加入的水(瓶①)和NaOH溶液(瓶②)的体积要_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】人类的生产生活离不开金属材料.
(1)人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”,在“五金”顺序中把金属__的位置移到最后,正好符合由弱到强的__顺序.
(2)铝、铁、铜是我们生产生活中使用比较广泛的金属.如图1所示用品中,利用金属导热性的是__,延展性的是__(填字母序号).

(3)铜也容易生锈,铜锈的主要成分是碱式碳酸铜(Cu2(OH)2CO3),是铜与空气中的氧气、水和__共同作用的结果.
(4)合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质.一般来说,合金的熔点低于任何一种组成金属的熔点.下表是一些金属的熔点数据.
金属 | 铜 | 锌 | 锡 | 铅 | 铋 | 镉 |
熔点/℃ | 1083 | 419.6 | 231.9 | 327.5 | 271.3 | 320.9 |
①铅锡合金中某种金属的质量分数与合金的熔点有如图2所示的关系,其中横坐标表示的是__的质量分数;当合金熔点最低时,合金中铅与锡的质量比为__.
②保险丝由铋、铅、锡、镉组成,其熔点约为__.
A.15~30℃; B.60~80℃; C.235~250℃; D.300~320℃.
查看答案和解析>>
科目: 来源: 题型:
【题目】水是人类宝贵的自然资源,与人类的生产、生活密切相关。
(1)水是常见的溶剂,将下列生活中的物质分别放入水中,不能形成溶液的是_____(填序号)。
A 蔗糖 B 纯碱 C 食盐 D 花生油
(2)“节约用水,从我做起”。请你写出一种生活中节约用水的做法_____。
(3)为了保护水质,下列做法合理的是_____(填序号)。
A 随意丢弃废旧电池
B 生活污水经处理达标后排放
C 农业上合理使用农药、化肥
D 工业“三废”未经处理任意排放
(4)通过电解水实验,可以知道水是由_____组成。正极上产生的气体具有的性质有_____(填序号)。
A 可以支持燃烧 B 易溶于水 C 作燃料
(5)生活中降低水的硬度的常用方法是_____。
(6)某兴趣小组展开对硝酸钾固体及其溶液的实验探究,现配制50克5%的硝酸钾溶液。
①如图所示操作正确的顺序是_____(填序号)。
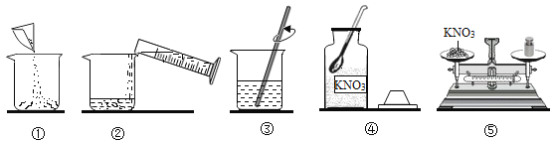
A ④⑤①②③
B ①②③④⑤
C ⑤②①④③
D ③④①②⑤
②本实验需称取硝酸钾固体_____g。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,
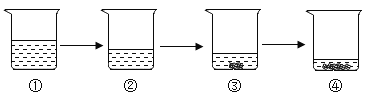
可以作出的正确判断是( )
A.在①→②过程中,氯化钠的质量分数保持不变
B.在②→③过程中,氯化钠的溶解度不断增大
C.在③→④过程中,水的质量分数不断增大
D.在②→④过程中,氯化钠的质量分数先不变后增大
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下表信息,相关说法正确的是( )
温度/℃ | 溶解度/g | |||
NaCl | KCl | NH4Cl | KNO3 | |
20 | 36.0 | 34.0 | 37.2 | 31.6 |
40 | 36.6 | 40.0 | 45.8 | 63.9 |
60 | 37.3 | 45.5 | 55.2 | 110 |
A.20℃时,NaCl的溶解度为36.0
B.40℃时,KCl饱和溶液的溶质质量分数为40%
C.40℃时,向100g水中加入50gNH4Cl充分溶解,溶液质量为145.8g
D.60℃时降温到20℃时,KNO3和KCl的饱和溶液析出晶体较多的是KCl
查看答案和解析>>
科目: 来源: 题型:
【题目】下列设计方案可行,化学方程式书写及其反应类型都正确的是( )
A. 清洗试管壁上附着的铜:Cu+H2SO4=CuSO4+H2↑置换反应
B. 测定空气中氧气的含量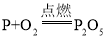 化合反应
化合反应
C. 用熟石灰处理硫酸厂的废水:Ca(OH)2 +H2SO4=CaSO4+2H2O复分解反应
D. 实验室制取二氧化碳: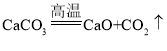 分解反应
分解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com