
科目: 来源: 题型:
【题目】为了测定某黄铜![]() 铜锌合金
铜锌合金![]() 样品的组成,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入硫酸,充分反应后用天平称量,记录实验数据如下:
样品的组成,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入硫酸,充分反应后用天平称量,记录实验数据如下:
试验次序 | 第1次 | 第2次 | 第3次 | 第4次 |
所取样品的质量
|
|
|
|
|
加入稀硫酸的质量 |
|
|
|
|
生成气体的质量 |
|
|
|
|
请回答下列问题并计算:
![]() 经分析,在第1次实验结束后,反应物______完全反应完了。
经分析,在第1次实验结束后,反应物______完全反应完了。
![]() 样品与足量稀硫酸反应最多能生成气体______g
样品与足量稀硫酸反应最多能生成气体______g
![]() 计算样品中锌的质量分数
计算样品中锌的质量分数![]() 写出具体计算过程
写出具体计算过程![]() 。______
。______
![]() 请在图中画出加入稀硫酸的质量与生成气体的质量的变化关系。______
请在图中画出加入稀硫酸的质量与生成气体的质量的变化关系。______

查看答案和解析>>
科目: 来源: 题型:
【题目】控制变量法是学习化学常用的方法,环保是实验必须提倡的内容,请你根据如图探究燃烧条件的实验图示和资料信息回答有关问题.
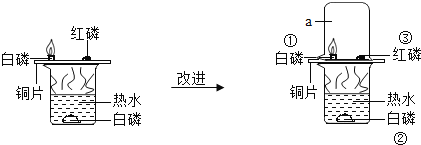
资料信息:白磷和红磷的着火点分别是![]() 、
、![]() .
.
![]() 水中的白磷不燃烧,是因为______.
水中的白磷不燃烧,是因为______.
![]() 罩上仪器a的作用是______.
罩上仪器a的作用是______.
![]() 对照①和③能够获得可燃物燃烧需要的条件之一是______.
对照①和③能够获得可燃物燃烧需要的条件之一是______.
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化钙钾石的化学式为KCl·xCaC12(x是CaCl2的系数)。它是一种天然的钾肥,溶于水后得到KCl与CaCl2的混合溶液。某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解得到KCl与CaCl2的混合溶液,向该溶液中逐滴加入Na2CO3溶液,产生的沉淀与加入Na2CO3溶液的质量关系如下图所示。请回答下列问题:
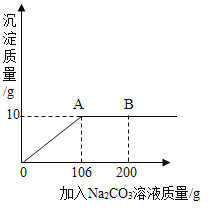
(1)写出Na2CO3与CaCl2反应的化学方程式______。
(2)图中AB段表示的意义是_________。
(3)18.55g氯化钙钾石样品中:
①CaCl2的质量是______g;
②KCl的质量是____g;
③钾元素的质量分数是______。
(4)所用Na2CO3溶液中溶质的质量分数是多少?(最后一问要求写出计算过程)____________
查看答案和解析>>
科目: 来源: 题型:
【题目】人类的生产生活离不开金属材料,随着科技水平的不断提高,金属及其合金在日常生活中扮演着越来越重要的角色.
(1)西汉时期中国古老的冶铜方法是“湿法冶铜”主要的反应原理是铁与硫酸铜溶液反应,写出反应的化学方程式_____.
(2)铁锅、铝锅是生活中常用的炊具,如图是铁锅的示意图.
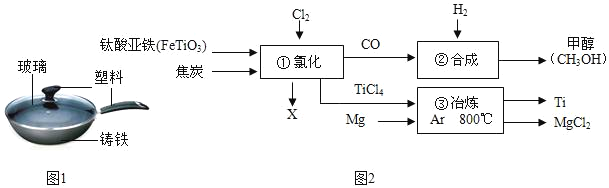
①铁锅含有的有机合成材料是_____.(填写名称).
②炒菜时铁锅中的油着火可用锅盖盖灭,其原理是_____.
③铜也易生锈,铜锈的主要成分是碱式碳酸铜(Cu(OH)2CO3),是铜与空气中的氧气、水和_____共同作用的结果.
(3)钛和钛合金被认为是21世纪的重要金属材料,被广泛用于火箭、导弹、航天飞机、船舶等,如图为某化工企业生产钛流程示意图:
请回答下列问题:
①FeTiO3中钛元素的化合价为_____;
②氯化中化学方程式为2FeTiO3+6C+7Cl2![]() 2C+2TiCl4+6CO2,则X为_____(填化学式).
2C+2TiCl4+6CO2,则X为_____(填化学式).
③合成中CO和H2以化学计量数1:2恰好完全反应,则该反应的基本反应类型是_____.
④冶炼中氩气的作用是_____,该步反应的化学方程式为_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上采用离子交换膜电解槽电解饱和食盐水,可得到高浓度的烧碱溶液(含NaOH 35%~48%),某兴趣小组欲验证一化工厂生产的NaOH溶液是否达到了高浓度标准,进行了如下操作,请你参与计算:
(1)用37%的浓盐酸配制200g7.3%的盐酸,需要加水(密度为1gmL﹣1)_____mL.(计算结果保留一位小数)
(2)采集该化工厂电解槽中的NaOH溶液20g,向其中滴入所配制的盐酸,当溶液的pH=7时,消耗盐酸100g,判断电解槽中NaOH溶液是否达到高浓度标准_________。(写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图象能正确反映对应变化关系的是( )
A. 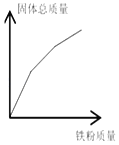 硝酸铜和硝酸银的混合溶液中加入铁粉
硝酸铜和硝酸银的混合溶液中加入铁粉
B. 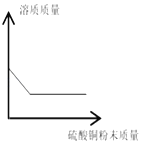 一定量的饱和硫酸铜溶液中加入硫酸铜粉末
一定量的饱和硫酸铜溶液中加入硫酸铜粉末
C. 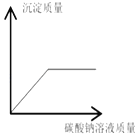 混有盐酸的氯化钙溶液中滴加碳酸钠溶液
混有盐酸的氯化钙溶液中滴加碳酸钠溶液
D. 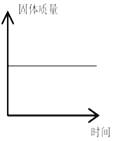 镁带在密闭容器中燃烧
镁带在密闭容器中燃烧
查看答案和解析>>
科目: 来源: 题型:
【题目】A、 B、 C、 D、 E 是初中化学常见的五种物质,其中 A 是一种单质, B 是一种有毒的气体, C 是植物光合作用的一种原料, D 是大理石的主要成分, E 可使紫色石蕊溶液变红。它们之间的转化关系如下图所示( “→”表示物质经一步反应即可转化)。
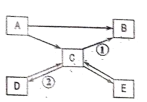
请回答下列问题。
(1) 写出下列物质的化学式: A________, C___________, E___________。
(2) ①的化学方程式是__________________________,基本反应类型是_________________。
②的化学方程式是__________________________,反应的现象是_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有某不纯的碳酸钠固体样品,已知其中含有的杂质可能是Na2SO4、CuSO4、NaCl、CaCl2中的一种或几种。为确定其杂质的成分,进行如下实验,出现的现象如图所示(设过程中所有发生的反应都恰好完全进行)。

请你根据实验过程和发生的现象做出分析判断,并填写以下空白:
(1)把气体D通入紫色石蕊溶液中,观察到的现象是_______________________。白色沉淀G的化学式是_____________。
(2)碳酸钠固体样品中一定含有的杂质是___________(写化学式)。
(3)碳酸钠固体样品中一定不含有的杂质是_________(写化学式)。
(4)请写出过程②中发生反应的一个化学方程式_____________________________ 。
(5)碳酸钠固体样品中还不能确定的物质是________________(写化学式),要确定它是否存在,可用溶液A再实验。请简述你的设计方案(说明实验操作步骤、发生的现象及结论)________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】称取NaCl和BaCl2的固体混合物32.5g,加入100g蒸馏水,完全溶解后向该混合溶液中逐滴加入质量分数为10%的Na2SO4溶液,反应生成BaSO4沉淀的质量与所加入的Na2SO4溶液的质量关系如下图所示。试回答下列问题:

(1)完全反应后生成BaSO4沉淀 g。
(2)恰好完全反应时消耗Na2SO4溶液的质量是 g。
(3)恰好完全反应时所得溶液中溶质的质量分数是多少?(精确到0.1%)
查看答案和解析>>
科目: 来源: 题型:
【题目】三种物质在密闭容器中发生反应,反应前后质量比例的变化关系如图所示,下列说法正确的是( )

A.反应中CaO为催化剂 B.该反应是复分解反应
C.反应后容器中固体质量减少 D.反应后容器中氧元素质量分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com