
【题目】数十亿年来,地球上的物质不断地发生变化,大气的成分也发生了很大变化。下表是原始大气和目前空气的成分:
空气的成分 | N2、O2、CO2、水蒸气及稀有气体He、Ne等 |
原始大气 的成分 | CH4、NH3、CO、CO2等 |
用上表所涉及的分子填写下列空白。
(1)含有10个电子的化学式有(填化学式,下同)________。
(2)由极性键构成的非极性分子有________。
(3)与H+可直接形成配位键的分子有________。
(4)分子中不含孤电子对的分子(除稀有气体外)有_______,它的立体构型为______。
(5)CO的结构可表示为O![]() C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
【答案】(1)H2O、Ne、CH4、NH3
(2)CH4、CO2(3)NH3、H2O
(4)CH4 正四面体形
(5)N2 不相同 配位键
【解析】(1)10e-分子可以用氖(Ne)作为标准,依次找出与氖同周期的元素与氢形成的化合物,有HF、H2O、NH3、CH4,题干要求用表中分子填空,不应填写HF。
(2)由极性键构成的非极性分子应是含有极性键且分子有对称结构的,应是CH4和CO2。
(3)H+有空轨道,与它形成配位键的分子应有孤电子对,据![]() 知,NH3和H2O可以和H+以配位键结合分别形成NH
知,NH3和H2O可以和H+以配位键结合分别形成NH![]() 和H3O+。
和H3O+。
(4)甲烷电子式为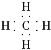 ,不存在孤电子对,且中心碳原子采用sp3杂化,故其立体构型为正四面体形。
,不存在孤电子对,且中心碳原子采用sp3杂化,故其立体构型为正四面体形。
(5)根据信息O![]() C知,C和O之间存在三个共价键,氮气中两个原子间也是三个共价键,与CO结构相似。但C和O电负性不同,共价键是极性键,而N2中两个氮原子形成的键是非极性键,O
C知,C和O之间存在三个共价键,氮气中两个原子间也是三个共价键,与CO结构相似。但C和O电负性不同,共价键是极性键,而N2中两个氮原子形成的键是非极性键,O![]() C中“→”表示氧原子单方提供电子对,是配位键。
C中“→”表示氧原子单方提供电子对,是配位键。


科目:高中地理 来源: 题型:
【题目】根据下表回答问题:
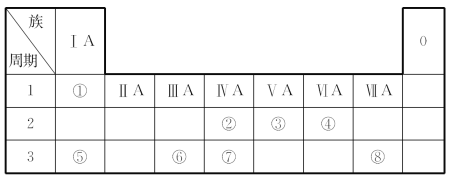
(1)元素⑦在周期表中的位置是___________________。
(2)元素①和⑤的原子序数相差 。
(3)写出元素⑤形成的常见化合物与元素⑧形成的单质反应的化学方程式________________。
(4)写出元素③形成的不同化合价的化合物的化学式(写出四个)________________________,
其中能与元素⑥形成的单质反应的化学方程式为______________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如下图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如下图乙所示。
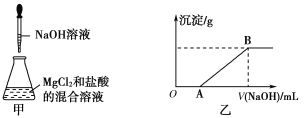
请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有______(填字母)。
a.天平 b.烧杯
c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为______________________________________。
(3)AB段反应的离子方程式为______________________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是________,反应的离子方程式为_____________________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】在研究原子核外电子排布与元素周期表的关系时,人们发现价电子层相似的元素集中在一起。据此,人们将元素周期表分为5个区,如图所示。
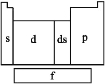
(1)在s区中,族序数最大、原子序数最小的元素是 ,其原子的外围电子的电子云形状为 。
(2)在d区中,族序数最大、原子序数最小的元素是 ,其常见离子的电子排布式为 ,其中较稳定的是 。
(3)在ds区中,族序数最大、原子序数最小的元素是 ,其原子的价电子层为 。
(4)在p区中,第二周期第ⅤA族元素原子的外围电子排布图为 。
(5)当今常用于核能开发的元素是铀和钚,它们在周期表中位于 区。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】小华在实验室进行以下实验:将四个完全相同的空心薄铁皮球分别放入四个盛有密度为ρ(g/cm3)的食盐水的烧杯中,铁球所处的位置如图所示。然后,他将水、密度均为ρ(g/cm3)的三种溶液(CuSO4、AgNO3、稀硫酸)分别加入上述四个烧杯中。回答下列问题:
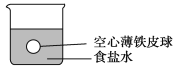
(1)加入水时,看到的现象是____________________________________________。
(2)加入稀硫酸时看到的现象是(假定整个反应过程中铁皮球壁完整)_____________________,发生反应的离子方程式是____________________________________________。
(3)加入CuSO4溶液时看到的现象是___________________________________________________,
发生反应的离子方程式是______________________________________________。
(4)加入AgNO3溶液时看到的现象是_________________________________,发生反应的离子方程式是_____________________________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】[2017天津节选]某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
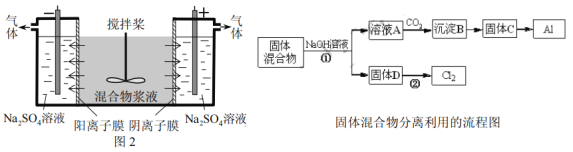
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________。B→C的反应条件为__________,C→Al的制备方法称为______________。
Ⅱ.含铬元素溶液的分离和利用
(2)用惰性电极电解时,![]() 能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】如下图所示的甲、乙、丙三种晶体:
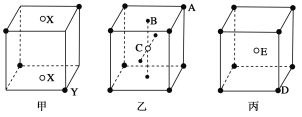
试写出:
(1)甲晶体的化学式(X为阳离子)为________。
(2)乙晶体中A、B、C三种粒子的个数比是________。
(3)丙晶体中每个D周围结合E的个数是________个。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)判断下列物质在相应条件下能否电离,并说明理由。
①液态HCl:__________________,理由:_________________________________。
②熔融状态下的NaCl:__________________,理由:_________________________________。
③高温熔化后的单质铁:__________________,理由:_________________________________。
④固体KOH:__________________,理由:________________________________。
(2)写出下列物质在水溶液中的电离方程式。
HCl:__________________________________________________________________;
H2SO4:________________________________________________________________;
Ca(OH)2:______________________________________________________________;
KOH:________________________________________________________________;
NH4NO3:_____________________________________________________________;
KAl(SO4)2:____________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com