
【题目】天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染.
资料:氰化钠化学式NaCN(C元素+2价,N元素﹣3价),白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢.
I、(1)NaCN水溶液呈碱性,其原因是____________(用离子方程式解释).
(2)双氧水氧化法除NaCN:碱性条件下加入H2O2,可得到纯碱和一种无色无味的无毒气体,该反应的离子方程式为____________________________.
(3)非金属性N______C(填“<”、“>”或“=”),请设计实验证明:_____________。
II、某化学兴趣小组实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放.
[实验一]实验室通过如图装置制备Na2S2O3.
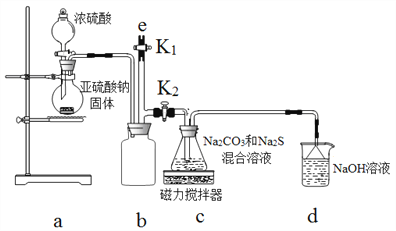
(4)b装置的作用是_______________.
(5)c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有__.
(6)实验结束后,在e处最好连接盛__(选填“NaOH溶液”、“水”、“CCl4”中任一种)的注射器,再关闭K2打开K1防止拆除装置时污染空气.
[实验二]测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量.
己知:①废水中氰化钠的最高排放标准为0.50mg/L.
②Ag++2CN—=[Ag(CN)2] —,Ag++I—=AgI↓,AgI呈黄色,且CN —优先与Ag+反应.
实验如下.取25.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000×10﹣4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为2.50mL.
(7)滴定终点的判断方法是_______________.
(8)处理后的废水中氰化钠的含量为_______________mg/L.
【答案】I、(1)CN-+H2O![]() HCN+OH-(2)2CN-+5H2O2+2 OH-=2CO32-+N2↑+6H2O
HCN+OH-(2)2CN-+5H2O2+2 OH-=2CO32-+N2↑+6H2O
(3)> 取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C (4)安全瓶,防止倒吸(5)Na2SO3(6)NaOH溶液(7)滴入最后一滴硝酸银溶液,出现淡黄色沉淀(8)0.98
【解析】本题为化学实验综合题,为高考必考题。考查化学实验方案的分析、评价和设计,物质的制备和含量的测定。
I、(1)NaCN是强碱弱酸盐,溶于水,CN-离子水解生成OH-,显碱性,离子方程式为CN-+H2O![]() HCN+OH-;(2)根据题给信息知碱性条件下,NaCN与H2O2反应纯碱和氮气,利用化合价升降法结合原子守恒、电荷守恒配平,该反应的离子方程式为2CN-+5H2O2+2 OH-=2CO32-+N2↑+6H2O;(3)非金属性N>C,可通过比较最高价氧化物水化物的酸性强弱来判断,实验方案为取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C。
HCN+OH-;(2)根据题给信息知碱性条件下,NaCN与H2O2反应纯碱和氮气,利用化合价升降法结合原子守恒、电荷守恒配平,该反应的离子方程式为2CN-+5H2O2+2 OH-=2CO32-+N2↑+6H2O;(3)非金属性N>C,可通过比较最高价氧化物水化物的酸性强弱来判断,实验方案为取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C。
II、[实验一]实验室装置制备Na2S2O3。a装置制备二氧化硫,c装置中制备Na2S2O3,反应导致装置内气压减小,b为安全瓶作用,防止溶液倒吸,d装置吸收多余的二氧化硫,防止污染空气。(4)b装置的作用是安全瓶,防止倒吸;(5)d装置吸收二氧化硫,d中溶质有NaOH、Na2CO3,碱过量,还有Na2SO3生成;(6)实验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收。
[实验二](7)根据信息②Ag++2CN—=[Ag(CN)2] —,Ag++I—=AgI↓,AgI呈黄色,且CN —优先与Ag+反应知Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,Ag+与I-生成AgI黄色沉淀,说明反应到达滴定终点,滴定终点的判断方法是滴入最后一滴硝酸银溶液,出现淡黄色沉淀;(8)消耗AgNO3的物质的量为:2.5×10-3L×0.0001mol/L=2.50×10-7mol,根据方程式Ag++2CN—=[Ag(CN)2] —,处理的废水中氰化钠的质量为5.00×10-7mol×49g/mol=2.45×10-5g,废水中氰化钠的含量为2.45×10-5mg÷0.025L=0.98mg/L。


 阅读快车系列答案
阅读快车系列答案科目:高中地理 来源: 题型:
【题目】烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ·mol-1
NO(g)+1/2O2(g)=NO2(g) △H=-58.2kJ·mol-1
SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ·mol-1
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_______mol·L-1。
(2)室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见图。
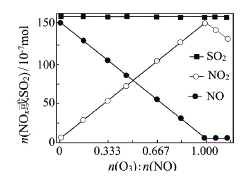
①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是__________。
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是 _________。
(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为 8)中SO32-将NO2转化为NO2-,其离子方程式为:___________。
(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)=________[用c(SO42-)、Ksp(CaSO3)和Ksp(CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是_________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>cCH3COO-)>c(OH-)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C.0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:![]() c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):
2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某物质在质谱仪中的最大质荷比为62,该物质的核磁共振氢谱吸收峰共有2组,红外吸收峰表明有O—H键和C—H键。下列物质符合的是( )
A.CH3COOH B.CH3—O—CH2OH
C.CH2OHCH2OH D.CH3—O—CH3
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
X | Y | Z | |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | KOH溶液 | Na2CO3 | 稀盐酸 |
③ | CO2 | Na2O2 | h2O |
④ | FeCl3溶液 | Cu | 稀硫酸 |
A.①③ B.①④ C.②④ D.②③
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】有关铝及其化合物的说法错误的是
A.铁易生锈,而铝在空气中较稳定,所以铁比铝活泼
B.可用铝壶烧开水,不可用其长期存放食醋、碱水
C.氧化铝是一种较好的耐火材料,但不可用氧化铝坩埚熔化NaOH
D.氢氧化铝能中和胃酸,可用于制胃药
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】下图为我国某水库常年平均朋均水位变化和月入库水量图,读图完成下列各题。
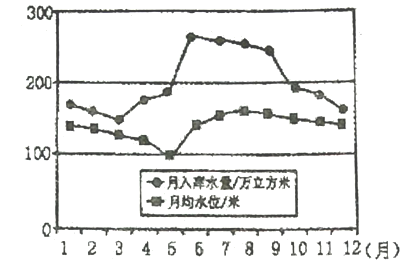
【1】该水库所在地区最可能是
A. 淮河流域 B. 太行山区 C. 松花江流域 D. 青藏高原
【2】下列关于该水库所在区域的说法,正确的是
A. 降水季节变化较小 B. 该水库水位随着入库水量的增加而升高
C. 6-8月水库水位在持续升高 D. 冬春季节水库入库水量多于出库水量
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】读“我国某区域图”,回答下列问题。
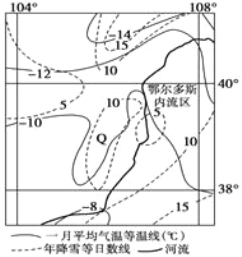
【1】Q处年降雪日数不同于周边地区的主要原因是 ( )
A.地势低平,水汽易进入
B.地势较高,气流受地形抬升
C.地势较高,位于东南季风的迎风坡
D.锋面遇地形阻挡,在此停滞
【2】与东北平原相比,该区发展农业的优势条件是 ( )
A.降水少,气候干旱
B.地形平坦,土壤肥沃
C.光照充足,昼夜温差大
D.机械化水平高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com