
【题目】(1)CH![]() 、CH3、CH
、CH3、CH![]() 都是重要的有机反应中间体,它们的电子式分别是________、________、________;其中CH
都是重要的有机反应中间体,它们的电子式分别是________、________、________;其中CH![]() 中四个原子是共平面的,三个键角相等,则键角应是________。
中四个原子是共平面的,三个键角相等,则键角应是________。
(2)叠氮化合物在化学工业上有重要应用。N![]() 叫做叠氮离子,请写出3种由三个原子构成的含有与N
叫做叠氮离子,请写出3种由三个原子构成的含有与N![]() 的电子数相同的粒子的化学式__________、__________、__________。
的电子数相同的粒子的化学式__________、__________、__________。
(3)N≡N键的键能为946 kJ/mol,N—N键的键能为193 kJ/mol,说明N2中的________键比________键稳定(填“σ”或“π”)
(4)CaC2中C![]() 与O
与O![]() 互为等电子体,O
互为等电子体,O![]() 的电子式可表示为________________;1 mol O
的电子式可表示为________________;1 mol O![]() 中含有的π键数目为________。
中含有的π键数目为________。
 全能练考卷系列答案
全能练考卷系列答案科目:高中地理 来源: 题型:
【题目】元素周期表中有相邻元素A、B、C,A与B同周期,B与C同主族,它们的原子最外层电子数之和为19,原子序数之和为41,则这三种元素的名称分别为:
A________,B________,C________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】能源“非石油化”是战略目标,发展以CH4、CO2等为原料的“C1化学”成为当今化工生产的必然趋势。通常天然气中含有H2S等有毒气体,下面为天然气合成氨的工艺流程。
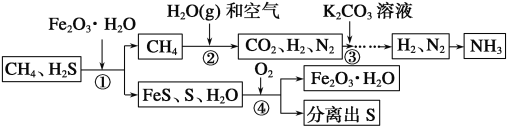
(1)合成氨的原料之一为氮气,该流程中为合成氨提供氮气的物质是__________。
(2)①处加入Fe2O3·H2O的目的是__________。
(3)②处CH4与H2O(g)反应生成CO2、H2,反应的化学方程式是_________________________。
(4)③处一般加入K2CO3溶液以吸收CO2,K2CO3溶液与CO2反应生成碳酸氢钾(KHCO3),该反应的化学方程式是________________________。
(5)该流程中参与循环的物质是__________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】聚酰胺66常用于生产帐篷、渔网、降落伞及弹力丝袜等织物,可利用下列路线合成:
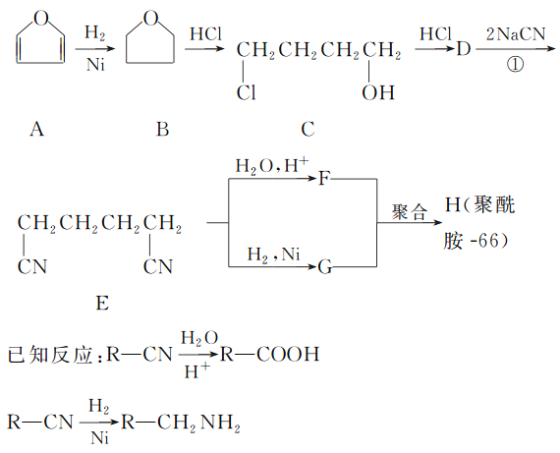
(1)能与银氨溶液反应的B的同分异构体的结构简式为________。
(2)D的结构简式为________;①的反应类型为________。
(3)为检验D中的官能团,所用试剂包括NaOH水溶液及________。
(4)由F和G生成H的反应方程式为______________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】五种元素的原子电子层结构如下:
A.1s22s22p63s23p63d54s1;B.1s22s22p63s2;C.1s22s22p6;D.1s22s22p63s23p;E.[Ar]4s1。
试回答:
(1)哪个式子是错误的________,它违背了________。
(2)哪个式子表示稀有气体原子________。
(3)A的元素符号是________,写出其价电子排布的轨道表示式________。
(4)B和E的金属性强弱关系为________(用元素符号表示),可以说明这一事实的依据是(写出2点)________________________ _。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】指出下列原子的杂化轨道类型及分子的结构式、立体构型。
(1)CS2分子中的C原子采取 杂化,分子的结构式为 ,立体构型为 ;
(2)CH2O中的C原子采取 杂化,分子的结构式为 ,立体构型为 ;
(3)CCl4分子中的C原子采取 杂化,分子的结构式为 ,立体构型为 ;
(4)H2S分子中的S原子采取 杂化,分子的结构式为 ,立体构型为 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知和碳元素同主族的X元素位于周期表中的第1个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们所形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为__________;Y元素原子最外层电子的电子排布图为__________。
(2)若X、Y两元素电负性分别为2.1和2.85,则XY4中X与Y之间的化学键为__________(填“共价键”或“离子键”)。
(3)该化合物的立体构型为__________,中心原子的杂化类型为__________,分子为__________(填“极性分子”或“非极性分子”)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)根据反应8NH3+3Cl2![]() 6NH4Cl+N2,回答下列问题:
6NH4Cl+N2,回答下列问题:
①该反应中氧化剂是 ,氧化产物是 。
②该反应中被氧化的物质与被还原的物质物质的量之比为 。
(2)某一反应体系中存在下列6种物质:NO、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O。已知存在下列转化关系:HNO3→NO,请完成下列各题:
①该反应的氧化剂是 ,还原剂是 。
②该反应中1 mol氧化剂 (填“得到”或“失去”) mol电子。
③当有0.1 mol HNO3被还原,此时生成标准状况下NO的体积是 L。
④请把各物质填在下面空格处,需配平:
□______+□______![]() □______+□______+□______+□
□______+□______+□______+□
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】下表是几种常见弱酸的电离平衡常数(25 ℃)。
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 1.75×10-5 |
H2CO3 | H2CO3
| K1=4.4×10-7 K2=4.7×10-11 |
H2S | H2S HS- | K1=9.1×10-8 K2=1.1×10-12 |
H3PO4 | H3PO4
| K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
回答下列各题:(1)当温度升高时,K值________(填“增大”“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?________________________________。
(3)若把CH3COOH、H2CO3、![]() 、H2S、HS-、H3PO4、
、H2S、HS-、H3PO4、![]() 、
、![]() 都看作是酸,其中酸性最强的是________,最弱的是________。
都看作是酸,其中酸性最强的是________,最弱的是________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数。对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是_________________,产生此规律的原因是_____________________________。
(5)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实________(填“能”或“不能”)比较醋酸与碳酸的酸性强弱,请设计一个简单的实验验证醋酸与碳酸的酸性强弱。
方案:______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com