
【题目】(1)根据反应8NH3+3Cl2![]() 6NH4Cl+N2,回答下列问题:
6NH4Cl+N2,回答下列问题:
①该反应中氧化剂是 ,氧化产物是 。
②该反应中被氧化的物质与被还原的物质物质的量之比为 。
(2)某一反应体系中存在下列6种物质:NO、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O。已知存在下列转化关系:HNO3→NO,请完成下列各题:
①该反应的氧化剂是 ,还原剂是 。
②该反应中1 mol氧化剂 (填“得到”或“失去”) mol电子。
③当有0.1 mol HNO3被还原,此时生成标准状况下NO的体积是 L。
④请把各物质填在下面空格处,需配平:
□______+□______![]() □______+□______+□______+□
□______+□______+□______+□
【答案】(1)①Cl2 N2 ②2∶3
(2)①HNO3 FeSO4 ②得到 3 ③2.24
④4HNO3+3FeSO4![]() Fe(NO3)3+Fe2(SO4)3+NO↑+2H2O
Fe(NO3)3+Fe2(SO4)3+NO↑+2H2O
【解析】(1)①在氧化还原反应8NH3+3Cl2![]() 6NH4Cl+N2中,氮元素化合价升高,被氧化,NH3作还原剂,N2是氧化产物;氯元素化合价降低,被还原,作氧化剂,NH4Cl是还原产物;故该反应的氧化剂是Cl2,还原剂是NH3;②若有8 mol NH3参与反应,则2 mol NH3被氧化,3 mol Cl2被还原,因此该反应中被氧化的物质与被还原的物质物质的量之比为2∶3;③氮元素失去6 mol e,氯元素得到6 mol e,故单线桥从氮元素出发,到氯元素终止,据此利用单线桥法标出电子转移的方向和数目;(2)①由于反应中存在转化关系:HNO3→NO,因此氮元素化合价降低,被还原,HNO3为氧化剂,NO为还原产物;因此铁元素一定是化合价升高,被氧化,FeSO4是还原剂,Fe(NO3)3和Fe2(SO4)3是氧化产物;故该反应的氧化剂是HNO3,还原剂是FeSO4;②1 mol氧化剂得到3 mol e;③当有0.1 mol HNO3被还原,根据原子守恒可知,生成NO的物质的量为0.1 mol,标准状况下的体积为
6NH4Cl+N2中,氮元素化合价升高,被氧化,NH3作还原剂,N2是氧化产物;氯元素化合价降低,被还原,作氧化剂,NH4Cl是还原产物;故该反应的氧化剂是Cl2,还原剂是NH3;②若有8 mol NH3参与反应,则2 mol NH3被氧化,3 mol Cl2被还原,因此该反应中被氧化的物质与被还原的物质物质的量之比为2∶3;③氮元素失去6 mol e,氯元素得到6 mol e,故单线桥从氮元素出发,到氯元素终止,据此利用单线桥法标出电子转移的方向和数目;(2)①由于反应中存在转化关系:HNO3→NO,因此氮元素化合价降低,被还原,HNO3为氧化剂,NO为还原产物;因此铁元素一定是化合价升高,被氧化,FeSO4是还原剂,Fe(NO3)3和Fe2(SO4)3是氧化产物;故该反应的氧化剂是HNO3,还原剂是FeSO4;②1 mol氧化剂得到3 mol e;③当有0.1 mol HNO3被还原,根据原子守恒可知,生成NO的物质的量为0.1 mol,标准状况下的体积为![]() ;④根据得失电子守恒,并结合原子守恒,可以配平化学方程式:4HNO3+3FeSO4
;④根据得失电子守恒,并结合原子守恒,可以配平化学方程式:4HNO3+3FeSO4![]() Fe(NO3)3+Fe2(SO4)3+NO↑+2H2O 。
Fe(NO3)3+Fe2(SO4)3+NO↑+2H2O 。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中地理 来源: 题型:
【题目】现有A、B、C三种烃,其球棍模型如下图:
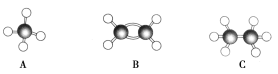
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是________(填对应字母,下同)。
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是________。
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是________,生成水最多的是________。
(4)在120 ℃、1.01×105 Pa条件下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)CH![]() 、CH3、CH
、CH3、CH![]() 都是重要的有机反应中间体,它们的电子式分别是________、________、________;其中CH
都是重要的有机反应中间体,它们的电子式分别是________、________、________;其中CH![]() 中四个原子是共平面的,三个键角相等,则键角应是________。
中四个原子是共平面的,三个键角相等,则键角应是________。
(2)叠氮化合物在化学工业上有重要应用。N![]() 叫做叠氮离子,请写出3种由三个原子构成的含有与N
叫做叠氮离子,请写出3种由三个原子构成的含有与N![]() 的电子数相同的粒子的化学式__________、__________、__________。
的电子数相同的粒子的化学式__________、__________、__________。
(3)N≡N键的键能为946 kJ/mol,N—N键的键能为193 kJ/mol,说明N2中的________键比________键稳定(填“σ”或“π”)
(4)CaC2中C![]() 与O
与O![]() 互为等电子体,O
互为等电子体,O![]() 的电子式可表示为________________;1 mol O
的电子式可表示为________________;1 mol O![]() 中含有的π键数目为________。
中含有的π键数目为________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2。
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式,并用双线桥法标出电子转移的方向和数目: 。
(4)若反应转移了0.3 mol电子,则产生的气体在标准状况下体积为 L。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某离子晶体晶胞结构如图所示,(![]() )X位于立方体的顶点,(○)Y位于立方体的中心,试分析:
)X位于立方体的顶点,(○)Y位于立方体的中心,试分析:
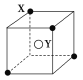
(1)晶体中每个Y同时吸引着________个X,每个X同时吸引着________个Y,该晶体的化学式为________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有________个。
(3)晶体中距离最近的2个X与一个Y形成的夹角∠XYX=________(填角的度数)。
(4)若该立方体的棱长为a cm,晶体密度为ρ g·cm-3,NA为阿伏加德罗常数,则该离子化合物的摩尔质量为________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:Cl、![]() 、
、![]() 、
、![]() 、K+、Na+。为确认溶液组成进行如下实验:
、K+、Na+。为确认溶液组成进行如下实验:
①200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。
②向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气
体1.12 L(已换算成标准状况,假定产生的气体全部逸出)。
(1)溶液一定存在的离子有 ,可能存在的离子有 ;
(2)原溶液中c(![]() )为 ,c(
)为 ,c(![]() ) c(
) c(![]() ) (填“>、<或=”);
) (填“>、<或=”);
(3)如果上述6种离子都存在,则c(Cl) c(![]() ) (填“>、<或=”)。
) (填“>、<或=”)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3、②NaHCO3、③HCl、④NH3·H2O
(1)上述溶液中,可发生水解的是_________(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为:_____________________________________。
(3)向④中加入少量氯化铵固体,此时c(![]() )/c(OH-)的值________(填“增大”“减小”或“不变”)。
)/c(OH-)的值________(填“增大”“减小”或“不变”)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是____________________________________。
(5)取10 mL溶液③,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=_______________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】金属钠与水的反应是中学化学中的一个重要反应。教材中该实验曾出现过几种不同的演示方法,分别如下图中甲、乙、丙所示:
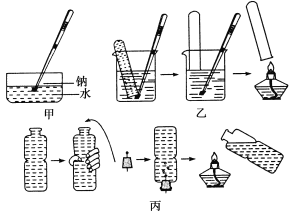
(1)现按图甲所示的方法,在室温时,向盛有饱和Ca(OH)2溶液的水槽中,加入一小块金属钠。下列现象描述正确的是________(填字母)。
A.钠浮在液面上,并四处游动,最后消失
B.钠熔化成一个光亮的小球
C.溶液底部有银白色物质生成
D.恢复到室温时,水槽底部有固体物质析出
(2)请补充并完成甲实验中从试剂瓶中取出钠到向水槽中投入钠的有关操作:用镊子从试剂瓶中取出一小块钠→__________________→用镊子夹取切好的金属钠投入到盛有Ca(OH)2溶液的水槽中。
(3)某同学用镊子夹住一块钠,按图乙所示方法来收集产生的气体,但钠很快脱落,实验没有成功。正确的操作应为________________________________________________。
(4)用装满水的矿泉水瓶按图丙方法进行实验。用手挤压矿泉水瓶并塞紧带有钠的塞子。共排出水的体积为16.8 mL,待钠反应结束后,干瘪的带塞矿泉水瓶恢复成原状,假设瓶内、瓶外均属于标准状况,则所用的钠的质量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com