
����Ŀ����������Ũ�Ⱦ�Ϊ0.5 mol/L��������Һ��
��Na2CO3����NaHCO3����HCl����NH3��H2O
��1��������Һ�У��ɷ���ˮ�����_________(����ţ���ͬ)��
��2��������Һ�У��������������Ʒ�Ӧ�����ܺ����ᷴӦ����Һ������Ũ���ɴ�С��˳��Ϊ��_____________________________________��
��3�������м��������Ȼ�粒��壬��ʱc(![]() )/c(OH��)��ֵ________(�������С�����䡱)��
)/c(OH��)��ֵ________(�������С�����䡱)��
��4����������������Һ��Ϻ���Һǡ�ó����ԣ�����ǰ�������________�������(����ڡ�����С�ڡ����ڡ�)����ʱ��Һ������Ũ���ɴ�С��˳����____________________________________��
��5��ȡ10 mL��Һ������ˮϡ�͵�500 mL�����ʱ��Һ����ˮ�������c(H+)=_______________��
��������1���٢�
��2��c(Na+)>c(![]() )>c(OH��)>c(H+)>c(
)>c(OH��)>c(H+)>c(![]() )
)
��3������
��4���� c(![]() )=c(Cl��)>c(H+)=c(OH��)
)=c(Cl��)>c(H+)=c(OH��)
��5��1��10��12 mol/L
����������1����Na2CO3����NaHCO3�е�![]() ��
��![]() ����ˮ�⡣
����ˮ�⡣
��2���������������Ʒ�Ӧ�����ܺ����ᷴӦ����Һ����NaHCO3��Һ��![]() ��ˮ��Ϊ������Һ������Ũ���ɴ�С��˳��Ϊc(Na+)>c(
��ˮ��Ϊ������Һ������Ũ���ɴ�С��˳��Ϊc(Na+)>c(![]() )>c(OH��)>c(H+)>c(
)>c(OH��)>c(H+)>c(![]() )��
)��
��3���������NH3��H2O![]()
![]() +OH��������NH4Cl����c(
+OH��������NH4Cl����c(![]() )����c(OH��)������c(
)����c(OH��)��С����c(![]() )/c(OH)��ֵ����
)/c(OH)��ֵ����
��4���������백ˮ�������ϣ���Һǡ�÷�Ӧ�꣬��Һ�����ԣ�������Һ�����ԣ���ζ����������㣬�������С�ڰ�ˮ������ɵ���غ�ԭ��֪��ʱc(![]() )=c(Cl��)����c(OH��)��
)=c(Cl��)����c(OH��)��
��5��ϡ�ͺ�c(HCl)=0.01 mol/L����c(OH��)=1��10��12 mol/L������ˮ�������c(H+)=1��10��12 mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����е��� ��Դ�� ���ͣ�
����Ŀ����Դ����ʯ�ͻ�����ս��Ŀ�꣬��չ��CH4��CO2��Ϊԭ�ϵġ�C1��ѧ����Ϊ���������ı�Ȼ���ơ�ͨ����Ȼ���к���H2S���ж����壬����Ϊ��Ȼ���ϳɰ��Ĺ������̡�
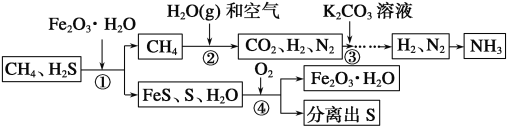
(1)�ϳɰ���ԭ��֮һΪ��������������Ϊ�ϳɰ��ṩ������������__________��
(2)�ٴ�����Fe2O3��H2O��Ŀ����__________��
(3)�ڴ�CH4��H2O(g)��Ӧ����CO2��H2����Ӧ�Ļ�ѧ����ʽ��_________________________��
(4)�۴�һ�����K2CO3��Һ������CO2��K2CO3��Һ��CO2��Ӧ����̼�����(KHCO3)���÷�Ӧ�Ļ�ѧ����ʽ��________________________��
(5)�������в���ѭ����������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����е��� ��Դ�� ���ͣ�
����Ŀ����֪��̼Ԫ��ͬ�����XԪ��λ�����ڱ��еĵ�1�������ڣ�������Ԫ��Yԭ�ӵ��������������ڲ����������3���������γɻ�����ķ���ʽ��XY4���Իش�
(1)XԪ�ص�ԭ�ӻ�̬ʱ�����Ų�ʽΪ__________��YԪ��ԭ���������ӵĵ����Ų�ͼΪ__________��
(2)��X��Y��Ԫ�ص縺�Էֱ�Ϊ2.1��2.85����XY4��X��Y֮��Ļ�ѧ��Ϊ__________(����ۼ��������Ӽ���)��
(3)�û���������幹��Ϊ__________������ԭ�ӵ��ӻ�����Ϊ__________������Ϊ__________(����Է��ӡ��Ǽ��Է��ӡ�)��
�鿴�𰸺ͽ���>>
��Ŀ�����е��� ��Դ�� ���ͣ�
����Ŀ��(1)���ݷ�Ӧ8NH3+3Cl2![]() 6NH4Cl+N2���ش��������⣺
6NH4Cl+N2���ش��������⣺
���÷�Ӧ���������� ������������ ��
���÷�Ӧ�б������������뱻��ԭ���������ʵ���֮��Ϊ ��
(2)ijһ��Ӧ��ϵ�д�������6�����ʣ�NO��FeSO4��Fe(NO3)3��HNO3��Fe2(SO4)3��H2O����֪��������ת����ϵ��HNO3��NO����������и��⣺
���÷�Ӧ���������� ����ԭ���� ��
���÷�Ӧ��1 mol������ (��õ�����ʧȥ��) mol���ӡ�
������0.1 mol HNO3����ԭ����ʱ���ɱ�״����NO������� L��
����Ѹ�������������ո�����ƽ��
��______+��______![]() ��______+��______+��______+��
��______+��______+��______+��
�鿴�𰸺ͽ���>>
��Ŀ�����е��� ��Դ�� ���ͣ�
����Ŀ����һ���Լ���ȥ���и������е�����(������Ϊ����)����д�����ӷ���ʽ��
(1)BaCl2(HCl)���Լ�________�����ӷ���ʽΪ_________________________��
(2)O2(CO2)���Լ�________�����ӷ���ʽΪ__________________________��
(3)![]() (
(![]() )���Լ�________�����ӷ���ʽΪ_______________________��
)���Լ�________�����ӷ���ʽΪ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����е��� ��Դ�� ���ͣ�
����Ŀ������������ײʱ����ȫ�����з�����Ӧ��10NaN3+2KNO3![]() K2O+5Na2O+16N2��������˵����ȷ����
K2O+5Na2O+16N2��������˵����ȷ����
A��KNO3�ǻ�ԭ�������е�Ԫ�ر�����
B���������е�N2���������K2O�ǻ�ԭ����
C��ÿת��1 mol ���ӣ������ɱ�״����N2�����Ϊ35.84 L
D������65 g NaN3�μӷ�Ӧ����������N�����ʵ���Ϊ3.2 mol
�鿴�𰸺ͽ���>>
��Ŀ�����е��� ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽS(l)+O2(g)![]() SO2(g) ��H1=293.23 kJ��mol1����������˵����ȷ����
SO2(g) ��H1=293.23 kJ��mol1����������˵����ȷ����
A����ӦS(s)+O2(g)![]() SO2(g)����ЧӦС�ڦ�H1
SO2(g)����ЧӦС�ڦ�H1
B����ӦS(g)+O2(g)![]() SO2(g)����ЧӦ���ڦ�H1
SO2(g)����ЧӦ���ڦ�H1
C��1 mol SO2(g)������С��1 mol S(l)��1 mol O2(g)������֮��
D��1 mol SO2 (g)����������1 mol S(l)��1 mol O2(g)������֮��
�鿴�𰸺ͽ���>>
��Ŀ�����е��� ��Դ�� ���ͣ�
����Ŀ���±��Ǽ��ֳ�������ĵ���ƽ�ⳣ��(25 ��)��
�� | ���뷽��ʽ | ����ƽ�ⳣ��K |
CH3COOH | CH3COOH | 1.75��10��5 |
H2CO3 | H2CO3
| K1=4.4��10��7 K2=4.7��10��11 |
H2S | H2S HS�� | K1=9.1��10��8 K2=1.1��10��12 |
H3PO4 | H3PO4
| K1=7.1��10��3 K2=6.3��10��8 K3=4.2��10��13 |
�ش����и��⣺��1�����¶�����ʱ��Kֵ________(�������С�����䡱)��
��2�����¶���ͬʱ���������Kֵ��ͬ����ôKֵ�Ĵ�С�����Ե����ǿ���кι�ϵ��________________________________��
��3������CH3COOH��H2CO3��![]() ��H2S��HS����H3PO4��
��H2S��HS����H3PO4��![]() ��
��![]() ���������ᣬ����������ǿ����________����������________��
���������ᣬ����������ǿ����________����������________��
��4����Ԫ�����Ƿֲ�����ģ�ÿһ��������Ӧ�ĵ���ƽ�ⳣ��������ͬһ�ֶ�Ԫ�����K1��K2��K3֮������������ϵĹ��ɣ��˹�����_________________�������˹��ɵ�ԭ����_____________________________��
��5����ʳ������ˮ����ˮ��������������е�ˮ����ͨ������ʵ________(��ܡ����ܡ�)�Ƚϴ�����̼�������ǿ���������һ����ʵ����֤������̼�������ǿ����
������______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����е��� ��Դ�� ���ͣ�
����Ŀ��[2017�¿α���]Li4Ti5O12��LiFePO4��������ӵ�صĵ缫���ϣ���������������Ҫ�ɷ�ΪFeTiO3������������MgO��SiO2�����ʣ����Ʊ��������������£�
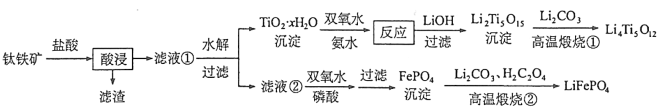
�ش��������⣺
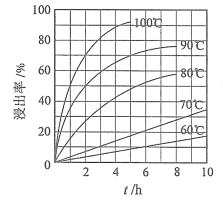
��1���������ʵ���У����Ľ����ʽ������ͼ��ʾ����ͼ��֪�������Ľ�����Ϊ70%ʱ�������õ�ʵ������Ϊ___________________��
��2���������������Ҫ��![]() ��ʽ���ڣ�д����Ӧ��Ӧ�����ӷ���ʽ__________________��
��ʽ���ڣ�д����Ӧ��Ӧ�����ӷ���ʽ__________________��
��3��TiO2��xH2O������˫��ˮ����ˮ��Ӧ40 min����ʵ�������±���ʾ��
�¶�/�� | 30 | 35 | 40 | 45 | 50 |
TiO2��xH2Oת����% | 92 | 95 | 97 | 93 | 88 |
����40 ��ʱTiO2��xH2Oת������ߵ�ԭ��__________________��
��4��Li2Ti5O15��Ti�Ļ��ϼ�Ϊ+4�����й���������ĿΪ__________________��
��5��������Һ������![]() ������˫��ˮ�����ᣨ����Һ�������1������ʹ
������˫��ˮ�����ᣨ����Һ�������1������ʹ![]() ǡ�ó�����ȫ����Һ��
ǡ�ó�����ȫ����Һ��![]() ����ʱ�Ƿ���Mg3(PO4)2�������ɣ� ����ʽ���㣩��FePO4��Mg3(PO4)2��Ksp�ֱ�Ϊ
����ʱ�Ƿ���Mg3(PO4)2�������ɣ� ����ʽ���㣩��FePO4��Mg3(PO4)2��Ksp�ֱ�Ϊ![]() ��
��
��6��д��������������������FePO4�Ʊ�LiFePO4�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com