
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:
c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
【答案】D
【解析】判断电解质溶液中离子浓度大小关系首先要确定电解质溶液的成分,是单一溶液还是混合溶液,若是两溶液混合,要理清是简单混合,还是有反应发生,理清溶液的最终组成;其次要分析溶液中存在的电离平衡、水解平衡等平衡,不可忽略水的电离平衡,然后结合相关信息判断平衡的主次,抓住弱电解质的电离及盐类的水解是微弱等特点做出判断;涉及等式关系要注意物料守恒式、电荷守恒式及质子守恒式的应用。结合选项逐个分析。A、H2S为二元弱酸,H2S溶液中存在H2S ![]() H+ + HS-、HS-
H+ + HS-、HS- ![]() H+ + S2-、H2O
H+ + S2-、H2O![]() H+ + OH-,一级电离程度远大于二级电离程度,根据上述分析知,pH=5的H2S溶液中,c(H+)=1×10—5 mol·L—1> c(HS-),错误;B、一水合氨为弱电解质,加水稀释,促进其电离,稀释过程中pH变化比强碱溶液稀释pH变化小。pH=a的氨水溶液,稀释10倍后,其pH=b,则a<b+1,错误;C、根据电荷守恒知,pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)+2 c( C2O42-),错误;D、已知酸性:CH3COOH>H2CO3>HClO,根据盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大,物质的量浓度相同时,溶液的碱性越强,PH越大,故pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的物质的量浓度:①>②>③,c(Na+):①>②>③,正确。
H+ + OH-,一级电离程度远大于二级电离程度,根据上述分析知,pH=5的H2S溶液中,c(H+)=1×10—5 mol·L—1> c(HS-),错误;B、一水合氨为弱电解质,加水稀释,促进其电离,稀释过程中pH变化比强碱溶液稀释pH变化小。pH=a的氨水溶液,稀释10倍后,其pH=b,则a<b+1,错误;C、根据电荷守恒知,pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)+2 c( C2O42-),错误;D、已知酸性:CH3COOH>H2CO3>HClO,根据盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大,物质的量浓度相同时,溶液的碱性越强,PH越大,故pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的物质的量浓度:①>②>③,c(Na+):①>②>③,正确。


 名校课堂系列答案
名校课堂系列答案科目:高中地理 来源: 题型:
【题目】下图表示几种自然灾害的持续时间,读图完成下列各题。
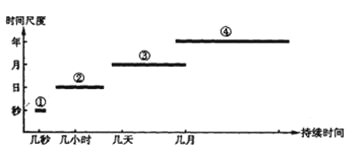
【1】①②③④四种灾害分别是
A.火山、地震、干旱、洪涝
B.地震、火山、洪涝、干旱
C.干旱、洪涝、地震、火山
D.火山、地震、洪涝、干旱
【2】蝗虫是危害严重的生物灾害。图中所示的自然灾害中,与其发生密切相关的是
A.①② B.②④ C.①②③ D.③④
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】读“城市化速度随时间的变化图”,回答下列问题。
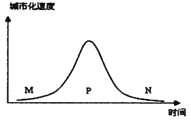
【1】关于图中各个时段城市化特点的叙述,正确的是
A.在M时段,城市化发展较快
B.在P时段,城市化水平较髙
C.在N时段,城市化水平较高
D.在N时段,人口向城市迅速集聚
【2】中国和英国分别处于图中的时段是
A.P、N B.N、P C.M、N D.P、M
【3】在P时段,一定不会出现的城市问题是
A.市区内平均行车速度明显下降 B.雾霾发生频率明显增加
C.大量人口从市区迁移到郊区 D.城市内涝严重
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知液态氯化氢和氯化钠固体均不能导电。下列物质中含有自由移动的Cl-的是
A.KClO3溶液 B.KCl溶液 C.液态HCl D.NaCl固体
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】25 ℃的下列溶液中,碱性最强的是( )
A.pH=11的溶液
B.c(OH-)=0.12 mol·L-1的溶液
C.1 L中含有4 g NaOH的溶液
D.c(H+)=1×10-10 mol·L-1的溶液
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】下列有关盐类水解的说法不正确的是( )
A.盐类水解过程破坏了纯水的电离平衡
B.盐类水解反应是酸碱中和反应的逆反应
C.盐类水解的结果使溶液不一定呈中性
D.Na2S溶液中c(Na+)是c(S2-)的2倍
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】___at my classmates’ faces,I read the same excitement in their eyes
A.Looking
B.Look
C.To look
D.Looked
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 ____ 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如图(忽略溶液体积的变化、H2S的挥发)。
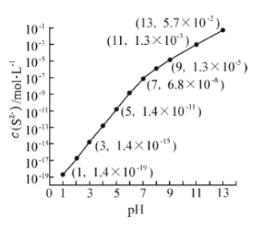
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3) 25℃,两种酸的电离平衡常数如右表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-4 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。关于标有“+”的接线柱,下列说法中正确的是( )
A.充电时作阳极,放电时作正极 B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com