
【题目】通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和生活质量的提高。下列各图所示的措施中,是为了增大化学反应速率的是( )。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 原电池是利用氧化还原反应将化学能转换为电能的装置
B. 由于生铁中含碳,所以比纯铁耐腐蚀
C. 在原电池中,电子从正极流向负极
D. 在原电池中,负极上发生还原反应,正极上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿魏酸在食品、医药等方面有广泛用途。一种合成阿魏酸的反应可表示为:
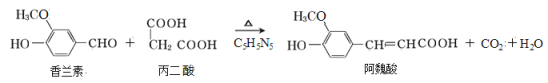
下列说法正确的是
A.可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
B.香兰素、阿魏酸均可与Na2CO3、 NaOH溶液反应
C.通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D.与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用惰性电极电解CuSO4溶液(如图的装置),
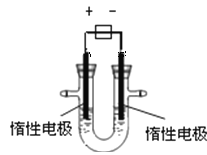
该过程中电解池电极反应式为是阳极: , 阴极: 。
(2)若电解池中装入足量溶液,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积(标准状况)为 (假设气体全部逸出)。
(3)欲使电解液恢复到起始状态,应向溶液中加入适量的
A.CuSO4 B.H2O C.CuO D.CuSO4·5H2O
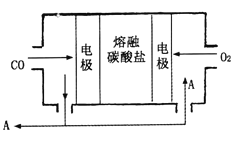
(4)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破。该电池示意图如右:负极电极反应式为_________________________,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环。A物质的化学式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课题式研究性学习是培养学生创造思维的良好方法.某研究性学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E是铁电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:

(1)电源B 极的名称是___________。
(2)甲装置中电解反应的总化学方程式是:________________________。
(3)设电解质溶液过量,则同一时间内C、D电极上参加反应的单质或生成的单质的物质的量之比是__________。
(4)欲用丙装置将粗铜(含少量铁、锌等杂质)精炼,G极材料应该是__________(填“粗铜”或“精铜”),电解液中原电解质的物质的量浓度将__________(填“变大”、“变小”或“不变”)。
(5)设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为 mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下列资料表示了三种金属被人类开发利用的大致年限。
![]()
(1)上述资料中的三种常用金属的开发利用之所以有先后,主要取决于________。
A.金属的导电性强弱 B.金属在地壳中的含量多少
C.金属的化合价高低 D.金属的活动性大小
(2)早在西汉成书的《淮南万毕术》里,就有“曾青得铁则化为铜”的记载。曾青又有空青、白青、石胆、胆矾等名称,其实都是天然的硫酸铜。
①写出“曾青得铁则化为铜”的化学方程式_________________________________________________。
②若根据上述反应设计成原电池,请在方框中画出原电池的装置图,标出正、负极和电解质溶液,并写出电极反应式。

正极反应: _______________________________________;
负极反应: _______________________________________。
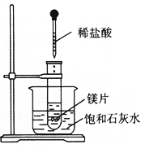
Ⅱ.在一只试管中放入几小块镁片,把试管放入盛有25 ℃的饱和石灰水
的烧杯中,用胶头滴管滴5 mL盐酸于试管中。试回答下列问题:
(1)实验中产生的现象是:____________________________________________________________。
(2)写出有关的化学方程式:____________________________________________________________。
(3)由实验推知:MgCl2溶液与H2的总能量________(填“<”“>”或“=”) Mg片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:

(1)负极反应式为________________________;正极反应式为__________________________。
(2)该电池工作时,H2和O2连续由外部供给,电池可连续不断地提供电能。因此,大量安全储氢是关键技术之一。
金属锂是一种重要的储氢材料,其吸氢和放氢原理如下:
Ⅰ.2Li+H22LiH
Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅱ中的氧化剂是________________;
②已知LiH固体密度为0.80g·cm-3,用锂吸收112 L(标准状况下)H2,生成的LiH体积与被吸收的H2体积比为__________(可用分数表示或用a×10-b表示,a保留两位小数);
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是( )
A. 液溴和苯分别受热变为气体
B. 干冰和氯化铵分别受热变为气体
C. 二氧化硅和铁分别受热熔化
D. 食盐和葡萄糖分别溶解在水中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com