
【题目】阿魏酸在食品、医药等方面有广泛用途。一种合成阿魏酸的反应可表示为:
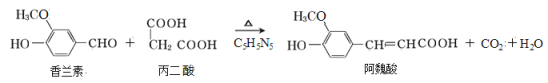
下列说法正确的是
A.可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
B.香兰素、阿魏酸均可与Na2CO3、 NaOH溶液反应
C.通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D.与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有3种
科目:高中化学 来源: 题型:
【题目】甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”。甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域。已知甲醇制备的有关化学反应如下:
反应①:CO(g)+2H2(g) ![]() CH3OH(g) △H1=-90.77kJ/mol
CH3OH(g) △H1=-90.77kJ/mol
反应②:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应③:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
(1)反应②的△H2=__________________
(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正________V逆(填“>”、“=”或“<”)
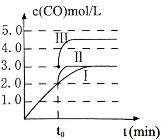
(3)在3L容积可变的密闭容器中发生反应②,c(CO)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。当曲线I变为曲线II时,改变的条件是 。当通过改变压强使曲线I变为曲线III时,曲线III达到平衡时容器的体积为_____________。
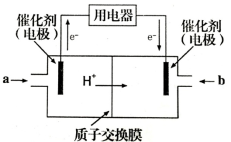
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池工作原理如图所示,则通入a气体的电极电极反应式为 。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的主要作用力依次是
A.范德华力、范德华力、氢键
B.范德华力、范德华力、共价键
C.共价键、共价键、共价键
D.范德华力、氢键、共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 578 | 1817 | 2745 | 11578 |
B | 738 | 1451 | 7733 | 10540 |
A通常显 价,B元素的核外电子排布式为 。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示),已知3种离子晶体的晶格能数据如下表:

离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是 。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(4)某配合物的分子结构如下图所示,其分子内不含有 (填序号)。

A.离子键
B.极性键
C.金属键
D.配位键
E.氢键
F.非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下图表示向10mLpH=3的A溶液中加水稀释到V1mL溶液pH的变化。下列说法中正确的是( )
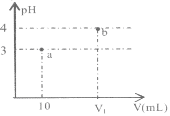
A.若V1=100,则稀释前A的浓度一定是0.001mol/L
B.若A为NH4Cl和HCl的混合溶液,则V1一定大于100
C.a点水的电离程度一定小于b点
D.若A为NH4Cl和NH3·H2O的混合溶液,则溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的资源宝库,海水中有大量可以利用的化学资源,例如氯化镁、氯化钠、溴化钠等。可用于制食盐、Mg、Br2、H2、Cl2、NaOH等化工原料。回答下列问题:
(1)Mg元素位于周期表第______周期_______族。
(2)写出NaOH的电子式_______________。
(3)写出电解饱和食盐水的离子方程式:____________。
(4)海水提溴要经过富集、氧化、提取的过程。其中氧化后生成的Br2可用Na2CO3溶液吸收,生成NaBr和NaBrO3及一种气体,写出该反应的化学方程式__________________。
(5)海水提取镁的过程中,得到MgCl2溶液后,先蒸发浓缩、冷却结晶、过滤制得MgCl2·6H2O,然后在HCl气流中加热得到MgCl2,而不是直接蒸发MgCl2溶液的原因是______________。
(6)海洋底部存在的可燃冰,是可开发的中药能源。常温常压下燃烧3.2g甲烷生成液态水,放出178kJ/mol的热量。写出甲烷燃烧的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应的化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) △=-92.3kJ/mol。一定温度下,向体积为2L的密闭容器中加入1mol N2和3mol H2,经2min后达到平衡,平衡时测得NH3的浓度为0.5 mol/L。
2NH3(g) △=-92.3kJ/mol。一定温度下,向体积为2L的密闭容器中加入1mol N2和3mol H2,经2min后达到平衡,平衡时测得NH3的浓度为0.5 mol/L。
(1)2min 内H2的反应速率v(H2)= ;
(2)充分反应并达到平衡时,放出的热量 92.3kJ(填“大于”、“小于”或“等于”)。
原因是 。
(3)下列说法可证明反应达到平衡状态的 。
A.单位时间内,断开1mol N≡N,同时断开3mol H—H
B.单位时间内,形成1mol N≡N,同时形成3mol N—H
C.单位时间内,断开1mol N≡N,同时断开6mol N—H
D.单位时间内,形成1mol N≡N,同时断开3mol H—H
(4)氨的一个重要用途是用于制备火箭发射原料N2H4(肼),已知:火箭发射的原理是N2H4(肼)在NO2中燃烧,生成N2、水蒸气。根据如下反应:
N2(g)+2O2(g)=2NO2(g) △H1=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=-534.0kJ/mol
写出在相同状态下,发射火箭反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和生活质量的提高。下列各图所示的措施中,是为了增大化学反应速率的是( )。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com