
【题目】某化学实验室需要480mL ,0.5mol/L的稀硫酸,现欲用98%的浓硫酸(ρ=1.84g/cm3 )配制,配制步骤包括:①计算所用浓硫酸的体积②转移③定容、摇匀④量取一定体积的浓硫酸⑤洗涤⑥稀释并冷却至室温⑦轻摇。完成下列问题:
(1)正确的操作步骤为(填入序号)___________________________。选用的主要仪器有:量筒、烧杯、玻璃棒、____________________________________________。
(2)应量取浓硫酸的体积为_______;量取浓硫酸所用的量筒的规格是__________(从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
(3)第⑥步中稀释实验的操作方法是__________________________。下列关于容量瓶的使用方法中,正确的是____________。
A.使用前要检验是否漏水B.在容量瓶中直接溶解固体或稀释液体
C.溶液未经冷却即注入容量瓶中D.向容量瓶中转移溶液要用玻璃棒引流
(4)下列情况中,所配制的稀硫酸浓度偏大的是___________。
A.所用的浓硫酸长时间放置在密封不好的容器中 B.容量瓶用蒸馏水洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤 D.定容时俯视刻度线
E.洗涤量取浓硫酸使用的量筒,并将洗涤液转移入容量瓶 F.用量筒量取浓硫酸时仰视刻度
【答案】 ①④⑥②⑤⑦③ 500mL容量瓶 胶头滴管 13.6mL B 向烧杯中先加一定量蒸馏水,再沿烧杯内壁缓缓加入量好的浓硫酸,并不断用玻璃棒搅拌 AD DEF
【解析】试题分析:(1)根据配制溶液的实验操作过程进行实验步骤排序;根据实验步骤分析需要的仪器;(2)①根据c=![]() 计算浓H2SO4的物质的量浓度,再根据溶液稀释前后溶质物质的量不变计算所需浓硫酸的体积;根据所需浓硫酸的体积选择量筒规格;(3)根据稀释浓硫酸的方法回答;根据容量瓶的使用方法回答;(4)根据
计算浓H2SO4的物质的量浓度,再根据溶液稀释前后溶质物质的量不变计算所需浓硫酸的体积;根据所需浓硫酸的体积选择量筒规格;(3)根据稀释浓硫酸的方法回答;根据容量瓶的使用方法回答;(4)根据![]() 分析误差;
分析误差;
解析:(1)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,所以实验操作步骤的正确顺序为①④⑥②⑤⑦③;
(2)①浓H2SO4的物质的量浓度c=![]() mol/L=18.4mol/L;应选用500 mL容量瓶,所以配制溶液的体积是500 mL。 设浓硫酸的体积为xmL,根据稀释定律,稀释前后溶质的物质的量不变, xmL×18.4mol/L=500mL×0.5mol/L,解得:x≈13.6。所需浓硫酸的体积为13.6mL;量取浓硫酸所用的量筒的规格是25 mL,选B。(3)稀释浓硫酸的方法:向烧杯中先加一定量蒸馏水,再沿烧杯内壁缓缓加入量好的浓硫酸,并不断用玻璃棒搅拌;A.容量瓶使用前要检验是否漏水,故A正确;B.在烧杯中溶解固体或稀释液体,故B错误;C.应将冷却后的溶液注入容量瓶中,故C错误;D.为防止液体流到容量瓶外,向容量瓶中转移溶液要用玻璃棒引流,故D正确;(4)A.浓硫酸具有吸水性,所用的浓硫酸长时间放置在密封不好的容器中,浓度变小,所配溶液浓度偏小,故A错误;B.容量瓶用蒸馏水洗涤后残留有少量的水,无影响,故B错误;C.所用过的烧杯、玻璃棒未洗涤,溶质物质的量偏小,浓度偏小,故C错误;D.定容时俯视刻度线,溶液体积偏小,浓度偏大,故D正确;E.洗涤量取浓硫酸使用的量筒,并将洗涤液转移入容量瓶,溶质溶质物质的量偏大,浓度偏大,故E正确; F.用量筒量取浓硫酸时仰视刻度,浓硫酸体积偏大,溶质溶质物质的量偏大,浓度偏大,故F正确;
mol/L=18.4mol/L;应选用500 mL容量瓶,所以配制溶液的体积是500 mL。 设浓硫酸的体积为xmL,根据稀释定律,稀释前后溶质的物质的量不变, xmL×18.4mol/L=500mL×0.5mol/L,解得:x≈13.6。所需浓硫酸的体积为13.6mL;量取浓硫酸所用的量筒的规格是25 mL,选B。(3)稀释浓硫酸的方法:向烧杯中先加一定量蒸馏水,再沿烧杯内壁缓缓加入量好的浓硫酸,并不断用玻璃棒搅拌;A.容量瓶使用前要检验是否漏水,故A正确;B.在烧杯中溶解固体或稀释液体,故B错误;C.应将冷却后的溶液注入容量瓶中,故C错误;D.为防止液体流到容量瓶外,向容量瓶中转移溶液要用玻璃棒引流,故D正确;(4)A.浓硫酸具有吸水性,所用的浓硫酸长时间放置在密封不好的容器中,浓度变小,所配溶液浓度偏小,故A错误;B.容量瓶用蒸馏水洗涤后残留有少量的水,无影响,故B错误;C.所用过的烧杯、玻璃棒未洗涤,溶质物质的量偏小,浓度偏小,故C错误;D.定容时俯视刻度线,溶液体积偏小,浓度偏大,故D正确;E.洗涤量取浓硫酸使用的量筒,并将洗涤液转移入容量瓶,溶质溶质物质的量偏大,浓度偏大,故E正确; F.用量筒量取浓硫酸时仰视刻度,浓硫酸体积偏大,溶质溶质物质的量偏大,浓度偏大,故F正确;


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】在一个容积可变的密闭容器中发生反应:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)。
Fe3O4(s)+4H2(g)。
回答下列问题:
(1)增加Fe的量,正反应速率 (填“增大”、“减小”或“不变”,下同)。
(2)将容器的容积缩小一半,正反应速率 ,逆反应速率 。
(3)保持容器的容积不变,充入N2使体系压强增大,正反应速率 ,逆反应速率 。
(4)保持压强不变,充入N2使容器的容积增大,正反应速率 ,逆反应速率 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 蛋白质的变性是可逆过程
B. 天然油脂没有恒定的熔点、沸点
C. 氨基乙酸不能溶于强酸溶液中
D. 蔗糖的水解产物不能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.糖类化合物也可称为碳水化合物B.油脂在碱性条件下能发生水解反应
C.医用消毒酒精中乙醇的浓度为95%D.用灼烧的方法可以区分蚕丝和人造纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轻质氧化镁是新型功能复合材料的重要添加剂,可由菱镁矿(含MgCO3、CaCO3、Fe2O3、Al2O3、SiO2)为原料制备,其制备流程如下:

(1)酸溶时,为了提高酸溶速率可采用的措施有______;提高矿物的浸取率可采取的措施有______。(各答一条即可)
(2)浓硫酸与Al2O3反应的化学方程式为___________;滤渣I的主要成分为______和______(填化学式)。
(3)用氨水调节溶液pH =8~9的目的是______,若氨水加的量较多使pH >9,则最终氧化镁的产量会______(填“增大”“不变”或“减小”)。
(4)沉镁时发生反应的离子方程式为________________。
(5)流程中“焙烧”操作若在实验室中进行,样品应放在______中加热(填仪器名称),当______时,说明固体样品已分解完全。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组分别给出了两个量,不可以求出相应物质的量的是
A | B | C | D |
物质微粒数 | 溶液的质量分数 | 标准状况下气体的摩尔体积 | 物质的质量 |
阿伏加德罗常数 | 溶液体积 | 标准状况下气体的体积 | 物质的摩尔质量 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。下列有关叙述不正确的是( )
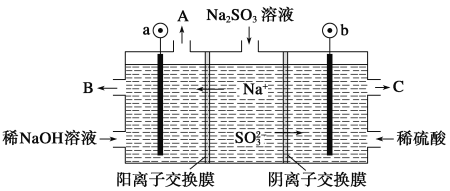
A.图中a极连接电源的负极
B.A口放出的物质是氢气,C口放出的物质是氧气
C.b极电极反应式为:SO32--2e-+H2O===SO42-+2H+
D.电解过程中阴极区碱性明显增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状态下,两种气态烷烃混合物的密度是1.16 g·L-1,此混合物组成不可能的是( )
A. 甲烷和乙烷 B. 乙烷和丙烷 C. 甲烷和丙烷 D. 甲烷和丁烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com