
黄铜矿(主要成分CuFeS2)是提取铜的主要原料.
(1)取12.5 g黄铜矿样品,经测定含3.60 g硫(杂质不含硫),矿样中CuFeS2含量为________.
(2)已知2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(炉渣)
Cu2S+3SO2+2FeO(炉渣)
产物Cu2S在1200高温下继续反应:
2Cu2S+3O2→2Cu2O+2SO2
2Cu2O+Cu2S→6Cu+SO2
假定各步反应都完全,完成下列计算:
①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量.
②6 mol CuFeS2和14.25 mol O2反应,理论上可得到多少摩尔铜?
③6 mol CuFeS2和15.75 mol O2反应,理论上可得到多少摩尔铜?
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源:2013-2014学年浙江省杭州市高三第二次月考化学试卷(解析版) 题型:填空题
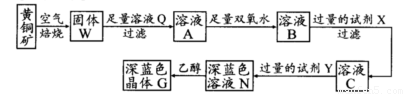
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
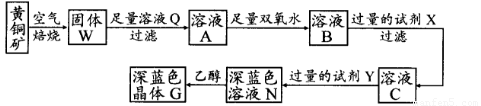
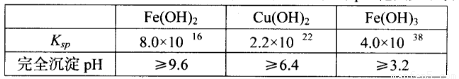
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
(1)黄铜矿在空气中焙烧能生成铁和铜的低价硫化物,写出其反应的化学方程式:???????????????????? ;
(2)试剂X的化学式为??????????????? ;
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为?????????????????? ,用pH试纸测该溶液pH值的方法是?????????????????????????????????????????????????? ;
(4)在溶液N中加入乙醇的目的是???????????????????????????????????????????????????? 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省文登市高三第二次统考理科综合化学试卷(解析版) 题型:填空题
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
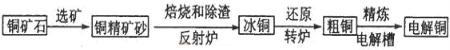
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,两种低价硫化物的化学式分别为________、_______。在反应过程中还有一部分Fe的硫化物转化为低价氧化物,其化学反应方程式为____________。
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量较低。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,,每有1mol氧气参加反应,生成氧化产物的物质的量为_________。生成的Cu2O与Cu2S反应,可制得含Cu量较高的粗铜。
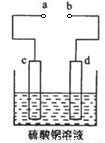
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,c为粗铜板, 则a端应连接电源的_____极(填“正”或“负”),若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极上发生反应的方程式有__________。
(4)可以应用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量。滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是____________,发生反应的离子方程式为_____________,滴定时,锥形瓶中的溶液会接触空气,测得铁元素的含量会____(填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省赣州市高三上学期期末联考理综化学试卷(解析版) 题型:填空题
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
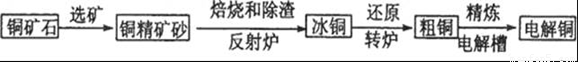
(1)在反射炉中,把铜精矿砂和石英砂混合加热到l000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主要反应的化学方程式分别是__________、__________,反射炉内生成炉渣的主要成分是__________;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O。生成的Cu2O与Cu2S反应,生成含Cu量约为98. 5%的粗铜,该过程发生反应的化学方程式分别是__________、__________。
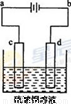
(3)粗铜的电解精炼如右图所示。在粗铜的电解过程中,粗铜板应是图中电极_____(填图中的字母);在电极d上发生的电极反应式为____________;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为______。
查看答案和解析>>
科目:高中化学 来源:2014届河南省许昌平顶山新乡三市高三第一次调研理综化学试卷(解析版) 题型:填空题
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
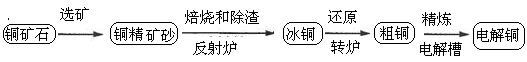
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是 、 ,反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、 ;
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板是图中电极 (填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。

查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省高三年级第一次联考理综化学试卷(解析版) 题型:填空题
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
|
|
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
Ksp |
8.0×10-16 |
2.2×10-22 |
4.0×10-38 |
|
完全沉淀pH |
≥9.6 |
≥6.4 |
≥3.2 |
(1)加快黄铜矿焙烧速率,可采用的措施有 (写两种):
(2)加入双氧水可能发生反应的离子方程式为 ;
试剂X的化学式为 。
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ;
用pH试纸测该溶液pH值的方法是
(4)已知Cu(OH)2+4NH3·H2O [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式:
。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式:
。
(5)在溶液N中加入乙醇的目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com