
| A. | CH4分子的球棍模型: | B. | 硝基苯的结构简式: | ||
| C. | 苯的最简式 C6H6 | D. | 1-丁醇的键线式: |
分析 A、球棍模型突出的是原子之间的成键的情况及空间结构;
B、硝基苯结构简式中,硝基的书写不规范,应该表示为:O2N-;
C、最简式是用元素符号表示化合物分子中各元素的原子个数比的最简关系式;
D、键线式用线段表示化学键,端点、交点为碳原子,碳原子、H原子不需要标出,杂原子及杂原子上的H原子需要标出.
解答 解:A、该图形是甲烷的比例模型,不是球棍模型,故A错误;
B、硝基写在苯环左侧时,应该表示为:O2N-,硝基苯正确的结构简式为: ,故B错误;
,故B错误;
C、苯的最简式为CH,故C错误;
D、 含有羟基为醇类,含有羟基的最长碳链为4,距离羟基最近的一端为1号碳,故为1-丁醇的键线式,故D正确,
含有羟基为醇类,含有羟基的最长碳链为4,距离羟基最近的一端为1号碳,故为1-丁醇的键线式,故D正确,
故选D.
点评 本题考查了电子式、球棍模型、结构简式、官能团等化学用语的表示方法,题目难度中等,注意掌握常见化学用语的表示方法,明确球棍模型表示的含义,选项B为易错点,注意硝基的正确书写方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 仅用酸性高锰酸钾溶液可区分苯和甲苯 | |
| B. | 仅用氯化铁溶液可区分苯酚稀溶液和甘油 | |
| C. | 仅用硝酸银溶液可验证卤代烃中卤原子的种类 | |
| D. | 仅用溴的四氯化碳溶液可区别液态的植物油和动物油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 温度T/℃ | A溶液 | B溶液 |
| ① | 30 | 20mL0.1mol•L-1H2C2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
| ② | 20 | 20mL0.1mol•L-1H2S2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
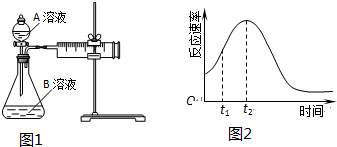
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
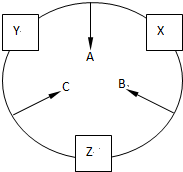 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.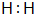
 NH4++OH-.
NH4++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
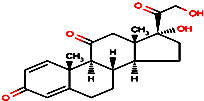 2014年广东省发现登革热病例.登革热是由登革热病毒引起的一种急性发热性疾病,其特征为发热、关节痛、肌肉痛、皮疹、淋巴结肿大和白细胞减少.对高热不退及毒血症状严重者,可短期应用小剂量肾上腺皮质激素,如口服泼尼松.泼尼松的结构简式如图所示,下列有关它的说法正确的是( )
2014年广东省发现登革热病例.登革热是由登革热病毒引起的一种急性发热性疾病,其特征为发热、关节痛、肌肉痛、皮疹、淋巴结肿大和白细胞减少.对高热不退及毒血症状严重者,可短期应用小剂量肾上腺皮质激素,如口服泼尼松.泼尼松的结构简式如图所示,下列有关它的说法正确的是( )| A. | 分子式为C21H22O5 | |
| B. | 属于芳香族化合物 | |
| C. | 1mol该物质最多能与5molH2发生加成反应 | |
| D. | 该物质能发生加成、取代、氧化、水解等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8+$\frac{1}{2}$ lg2 | B. | 9+lg2 | C. | 10+$\frac{1}{2}$ lg2 | D. | 11+2lg2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
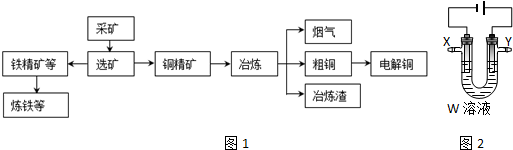
| 金属氢氧化物 | 开始沉淀pH | 完全沉淀的pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.7 |
| Cu(OH)2 | 4.6 | 6.4 |
| Zn(OH)2 | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(N2)=V╯(NH3) | B. | V(N2)=3V(H2) | ||
| C. | V(H2)=3/2V╯(NH3) | D. | N2,H2,NH3的体积比为1:3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com