
| A. | V(N2)=V╯(NH3) | B. | V(N2)=3V(H2) | ||
| C. | V(H2)=3/2V╯(NH3) | D. | N2,H2,NH3的体积比为1:3:2 |
分析 可逆反应中正逆反应速率相等时该反应达到平衡状态,平衡体系中各物质物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.V(N2)=V╯(NH3)时,反应速率与其计量数之比不相等,所以各物质的正逆反应速率不相等,则该反应没有达到平衡状态,故A错误;
B.无论是否达到平衡状态,始终存在V(N2)=3V(H2),所以不能据此判断平衡状态,故B错误;
D.V(H2)=3/2V╯(NH3),同一物质的正逆反应速率相等,所以反应达到平衡状态,故C正确;
D.N2、H2、NH3的体积比为1:3:2时,该反应不一定达到平衡状态,与反应初始浓度及转化率有关,所以不能据此判断平衡状态,故D错误;
故选C.
点评 本题考查化学平衡状态的判断,只有反应前后改变的物理量才能作为判断依据,再结合同一物质的正逆反应速率相等判断,题目难度不大.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
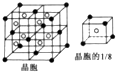 已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:
已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:| 元素 | 性质或结构信息 |
| A | 单质为黄色粉末,难溶于水,能形成2种二元含氧酸 |
| B | M层有1个未成对的p电子,核外电子总数大于7 |
| C | 与锂形成的合金常用于航天飞行器,单质能溶于强酸和强碱 |
| D | S电子总数比p电子总数少2个,单质或氧化物均具有很高的熔、沸点 |
| E | 周期表中电负性最大的元素 |
| F | 最外层有2个电子,但次外层有18个电子 |
 .
.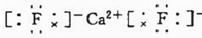 .已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).
.已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃料电池是通过燃烧方式将化学能转换为电能 | |
| B. | 氢氧燃料电池中,通入氢气的一极为正极 | |
| C. | 氢氧燃料电池是一种环境友好电池 | |
| D. | 燃料电池的能量转化率可达100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③⑤ | C. | ①③⑥ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得的分散系属于悬浊液 | |
| B. | 所得的分散系中分散质为Fe2O3 | |
| C. | 该分散系能产生丁达尔效应 | |
| D. | 所得分散系为胶体,且胶粒直径即为氢氧化铁分子直径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氢氟酸在玻璃上镌刻图案:4I++SiO2═H2O+Si4+ | |
| B. | 向Cu2+、Fe3+混合液中加入CuO除去Fe3+;3H2O+3CuO+2Fe3+═2Fe(OH)3+3Cu2+ | |
| C. | 亚硫酸氢钠溶液显酸性:HSO3-═H++SO32- | |
| D. | 用盐酸与碳酸钠反应证明氯的非金属性强与炭:2H++CO32-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
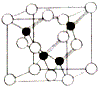 氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途.
氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途.| 物质 | 熔点/℃ | 沸点/℃ | 分解温度/℃ |
| NH3 | 195.3 | 239.7 | 107.3 |
| PH3 | 139.2 | 185.4 | 713.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在某密闭容器中进行 以下反应:M(g)+N(g)?R(g)+2L(?),且此反应符合如图所示图象.图中R%表示R在平衡混合物中的含量,T1、T2表示体系温度,P1、P2表示体系压强.请判断
在某密闭容器中进行 以下反应:M(g)+N(g)?R(g)+2L(?),且此反应符合如图所示图象.图中R%表示R在平衡混合物中的含量,T1、T2表示体系温度,P1、P2表示体系压强.请判断查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com