
 氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途.
氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途.| 物质 | 熔点/℃ | 沸点/℃ | 分解温度/℃ |
| NH3 | 195.3 | 239.7 | 107.3 |
| PH3 | 139.2 | 185.4 | 713.2 |
分析 (1)As为35号元素,据此书写基态核外电子排布式;同主族第一电离能顺序逐渐减小;
(2)N2O的分子结构不对称,正负电荷的中心不重合,所以是极性分子;N2O与CO2互为等电子体,中间氮原子是中心原子,其杂化类型与C相同,都是sp杂化;
(3)氨分子间形成氢键,所以熔沸点较高;PH3熔化或气化时所需克服的微粒间作用力,与其分解时所需克服的微粒间作用力是不相同的;
(4)孤对电子对σ键的排斥力>σ键和σ键的排斥力,据此解答;计算出PO43-离子的中心原子的价层电子对数判断即可;
(5)依据均摊法计算晶胞中各种原子的个数,确定化学式.
解答 解:(1)As为35号元素,其基态原子的核外电子排布式为:[Ar]3d104s24p3,同主族第一电离能顺序随着原子序数的递增而逐渐减小,故第一电离能:N>P>As,故答案为:[Ar]3d104s24p3;N、P、As;
(2)N2O的结构式为N=N=O,由于它的分子结构不对称,正负电荷的中心不重合,所以是极性分子,N2O为直线形分子,且与CO2互为等电子体,中间氮原子是中心原子,其杂化类型与C相同,都是sp杂化,故答案为:极性;sp;
(3)由于NH3分子之间存在氢键,所以NH3的沸点高于PH3,PH3分解需要破坏P-H键,PH3气化需要破坏分子间作用力,而化学键比分子间作用力强得多,故答案为:NH3分子之间存在氢键;PH3分解需要破坏P-H键,PH3气化需要破坏分子间作用力,而化学键比分子间作用力强得多;
(4)氨气分子中存在1对孤电子对,孤对电子对σ键的排斥力>σ键和σ键的排斥力,所以氨分子中的键角小于109°28′,PO43-离子的中心原子的价层电子对数为$\frac{5+3}{2}$=4对,配位原子有4个,所以是正四面体结构,故答案为:<; 正四面体;
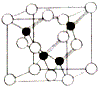
(5)据图所知:每个结构单元中含有4个黑球,8×$\frac{1}{8}$+6×$\frac{1}{2}$=4个白球,故晶胞中磷原子与铝原子的个数比为1:1,所以晶体的化学式为AlP,故答案为:AlP.
点评 本题主要考查的是基态原子核外电子排布式、晶胞的计算、杂化类型的判断、氢键等知识,综合性较强,有一定难度.


科目:高中化学 来源: 题型:解答题
| 金属氢氧化物 | 开始沉淀pH | 完全沉淀的pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.7 |
| Cu(OH)2 | 4.6 | 6.4 |
| Zn(OH)2 | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(N2)=V╯(NH3) | B. | V(N2)=3V(H2) | ||
| C. | V(H2)=3/2V╯(NH3) | D. | N2,H2,NH3的体积比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y |
| Z | W |
| A. | 若HmXOn为强酸,则Y的氢化物溶于水显酸性(m、n均为正整数) | |
| B. | 若W(OH)n为两性氢氧化物,则Z(OH)m为强碱(m、n均为正整数) | |
| C. | 若气体XHn不溶于水,则HmWOn为强酸(m、n、a均为正整数) | |
| D. | 若HmZOn为强酸,则气体HnY易溶于水(m、n、a均为正整数) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “海水淡化”可以解决“淡水供应危机”,加入明矾可以使海水淡化 | |
| B. | 化学药品着火,都要立即用水或泡沫灭火器灭火 | |
| C. | 可溶性铜盐有毒,但在生命体中,铜是一种不可缺少的微量元素 | |
| D. | 石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 种 | B. | 3 种 | C. | 4 种 | D. | 5 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +(CH3CO)2O→
+(CH3CO)2O→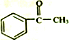 +CH3COOH
+CH3COOH ;B
;B .
. 直接制取
直接制取 ,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.
,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.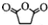 +
+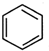 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$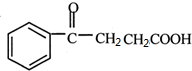 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入甲基橙试液显红色的溶液:Mg2+、Al3+、Br-、SO42- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010的溶液中:Na+、NH4+、ClO-、I- | |
| C. | 0.1mol/LNaHCO3溶液中:K+、Ba2+、OH-、Cl- | |
| D. | 加入铝粉放出大量H2的溶液中:Fe2+、K+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com