
【题目】足量的金属铁与下列酸溶液反应,初始反应速率最快且最终产生氢气最多的是( )
A.100mL0.1mol/L盐酸
B.100mL0.2mol/L硝酸
C.75 mL0.2mol/L盐酸
D.20mL18.4mol/L硫酸
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )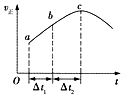
A.反应物的总能量低于生成物的总能量
B.△t1=△t2时,CO的转化率:a~b段小于bc段
C.反应在c点达到平衡状态
D.反应物浓度:a点小于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述不正确的是( )

A. 25℃时,醋酸的电离常数Ka=1×10-4.75
B. pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
C. pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol·L-1
D. W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中,反应A+2BC分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L 及 c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是:
②; .
③; .
(2)实验②平衡时B的转化率为;实验③平衡时C的浓度为;
(3)该反应的△H0,其判断理由是
(4)该反应进行到4.0min时的平均反应速率:
实验②:vB=
实验③:vc= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】本草纲目记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次价值数倍也”。其方法与下列分离方法相对应的是( )
A.蒸馏B.蒸发C.过滤D.分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解食盐水的原理是:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。成品碱中含有氯化钠杂质,可通过分光光度法测定每克成品碱中氯化钠的含量,其测量值(吸光度A)与每克成品碱中氯化钠含量的关系如下图,氯化钠杂质小于0.0050%的成品碱为优品级。下列说法不正确的是
2NaOH+H2↑+Cl2↑。成品碱中含有氯化钠杂质,可通过分光光度法测定每克成品碱中氯化钠的含量,其测量值(吸光度A)与每克成品碱中氯化钠含量的关系如下图,氯化钠杂质小于0.0050%的成品碱为优品级。下列说法不正确的是

A. 吸光度A的值越大,样品中氯化钠含量越小
B. 分光光度法是对物质组成进行定性和定量的测定
C. 图中G点所测的成品碱不是优品级
D. 成品碱是否含有NaCl,可用硝酸酸化的硝酸银溶液检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向盛有50mLpH=2的HA溶液的绝热容器中加入pH =13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是

A. a→b 的过程中,混合溶液中可能存在:c(A-)=c(Na+)=c(H+) =c(OH-)
B. HA的物质的量浓度为0.01mol/L
C. b点时,溶液中存在:c(Na+)>c(A-)>c(OH-)>c(H+)
D. b→c的过程中,温度降低的原因是溶液中发生了吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去工业尾气中的氮氧化合物(如NO),常用氨催化吸收法,原理是NH3与NO按一定比例反应生成无毒物质。某同学在实验室里采用以下装置和步骤模拟工业上对NO的处理。

(1)装置A的反应中,还原产物是_____。
(2)若选择装置C制取氨气,则反应的化学方程式是______。
选用上述部分装置,按下列顺序连接成模拟尾气处理装置,回答有关问题:
(3)在括号中填入选用的装置编号:![]() 。______、___________
。______、___________
(4)装置D的一种作用是______。
(5)装置B的作用是______(填序号)。
A.吸收氮氧化物 B.吸收氨气 C.干燥反应的混合气体
(6)装置E中发生反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的操作、现象及实验原理或结论均正确的是( )
实验目的 | 操作和现象 | 实验原理或结论 | |
A | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 向1mLlmol·L-1MgCl2溶液中滴加2滴2mol·L-1NaOH溶液,生成白色沉淀;再滴加2滴1mol·L-1'FeCl3溶液,白色沉淀变成红褐色沉淀 | 3Mg(OH)2(s)+2Fe3+(aq) |
B | 比较HClO和CH3COOH的酸性 | 室温下,用pH试纸分别测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 酸越弱,酸根离子水解程度越大,其盐溶液碱性越强 |
C | 提纯混有少量硝酸钾的氯化钠固体 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升高显著增大 |
D | 检验某溶液中是否含有SO42- | 向该溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com