
某化学小组在学习元素周期律知识后,对教材中Cl2将Fe2+氧化成Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化成Fe3+,那么Br2和I2能否将Fe2+氧化成Fe3+?
环节一:理论推测。
部分同学认为Br2和I2都能将Fe2+氧化成Fe3+,依据是____________________
_________________________________________________________________。
部分同学认为Br2和I2都不能将Fe2+氧化成Fe3+。还有同学认为Br2能将
Fe2+氧化成Fe3+,而I2不能,依据是同一主族从上到下卤素单质的氧化性逐渐减弱。
环节二:设计实验进行验证。
向大试管中加入适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
试管 | 操作 | 现象 |
① | 先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量红棕色的溴水,振荡试管 | 溶液为 黄色 |
② | 先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量棕黄色的碘水,振荡试管 | 溶液为 黄色 |
环节三:实验现象的分析与解释。
(1)甲同学认为试管①中的现象说明溴水能将Fe2+氧化,反应的离子方程式为_________________________________________________________________。
乙同学认为应该补做实验,才能得出甲同学的结论。请你帮助乙同学完成实验:
实验2:
操作 | 现象 |
|
|
(2)该小组同学对试管②中所得的溶液呈黄色的原因展开讨论,并提出了两种假设:
假设1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
假设2.________________。
实验3:进行实验以判断假设是否成立。
操作 | 现象 |
向试管②所得的溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间。取出上层溶液,滴加KSCN溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;取上层溶液滴加KSCN溶液后,溶液呈浅红色 |
丙同学认为实验3的现象可以说明假设2成立,丁同学认为不严谨,于是设计了实验4继续探究。
实验4:
操作 | 现象 |
向另一支试管中加入2 mL新制的FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间。取出下层溶液,滴加KSCN溶液 | 静置后,上层溶液为紫色,下层溶液几乎无色;取下层溶液,向其中滴加KSCN溶液后,溶液没有呈浅红色 |
你认为实验4中加入乙酸乙酯的主要目的是___________________________。
丁同学根据实验4的现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,从原子结构角度解释原因:______________________________________________________________________。
环节一:均为ⅦA族元素,其单质的氧化性均较强环节三:(1)2Fe2++Br2=2Fe3++2Br-
操作 | 现象 |
取少量试管①中的黄色溶液于试管③中,滴加少量KSCN溶液,振荡 | 溶液变为红色 |
(2)碘水与FeCl2溶液发生反应,FeCl3溶液呈黄色 亚铁离子与空气接触会被氧化,加入的乙酸乙酯既可作萃取剂又能起到液封的作用,防止空气对实验产生干扰
(3)同一主族元素从上到下,原子核外的电子层数依次增多,原子半径逐渐增大,得电子能力逐渐减弱,氧化性逐渐减弱
【解析】由题给信息和实验目的可知部分同学认为Br2和I2都能将Fe2+氧化成Fe3+的依据是这些单质均为ⅦA族元素的单质,氧化性均较强。
(1)实验1的试管①中发生反应的离子方程式为2Fe2++Br2=2Fe3++2Br-。由于甲同学的结论仅仅是根据溶液颜色的变化得出的,所以结论不一定可靠,必须通过实验进行验证,可探究该过程中是否有三价铁离子生成,所以实验的设计应是三价铁离子的检验,故对应的方案为取少量试管①中的黄色溶液于试管③中,滴加少量KSCN溶液,振荡,若溶液变为红色则表明有三价铁离子生成。
(2)可根据物质的颜色分析试管②中所得溶液呈黄色的可能原因,一是碘水的颜色,二是三价铁离子的颜色。实验方案的设计需从这两个方面进行考虑,同时需要考虑亚铁离子在空气中容易被氧化成三价铁离子,所以实验的设计必须排除空气的影响,即实验4中加入乙酸乙酯的主要目的一是乙酸乙酯可作萃取剂,二是防止空气中的氧气将亚铁离子氧化成三价铁离子。


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源:2014年高中化学二轮创新训练上 专题6化学反应速率和化学平衡练习卷(解析版) 题型:填空题
25 ℃时,在体积为2 L的密闭容器中,气态A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。
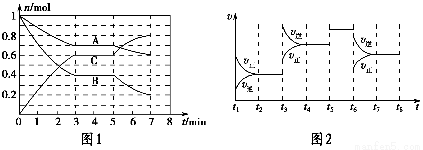
t2~t3 | t4~t5 | t5~t6 | t7~t8 |
K1 | K2 | K3 | K4 |
(1)根据图1数据,写出该反应的化学方程式:__________________。此反应的平衡常数表达式K=________,从反应开始到第一次平衡时的平均速率v(A)为________。
(2)在5~7 min内,若K值不变,则此处曲线变化的原因是________________。
(3)如图2表示此反应的反应速率v和时间t的关系图,各阶段的平衡常数如表所示。K1、K2、K3、K4之间的关系为________(用“>”、“<”或“=”连接)。A的转化率最大的一段时间是________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题3常见的两种重要反应类型练习卷(解析版) 题型:选择题
下列各组物质中只具有还原性的是 ( )。
A.F-、CO、Na B.Na、I-、Zn
C.Fe3+、SO42-、NO3- D.Fe3+、O2、H2O2
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题15有机化学基础选考练习卷(解析版) 题型:填空题
聚邻苯二甲酸二烯丙酯(DAP-A)是一种优良的热固性树脂,这种材料可以采取下列路线合成:
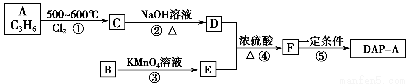
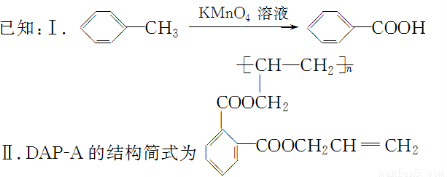
(1)反应①~④中,属于取代反应的是________。
(2)写出有关反应的化学方程式:
反应②___________________________________________________________;
反应④___________________________________________________________。
(3)G是E的同分异构体,G具有如下性质:①能发生银镜反应,且1 mol G与银氨溶液反应时最多可得到4 mol Ag;②遇FeCl3溶液呈紫色;③在稀硫酸中能发生水解反应。
则符合上述条件的G最多有________种,这些不同结构的物质,它们的核磁共振氢谱峰的数目有何特点?_______________________________________________________。
(4)工业上可由C经过两步反应制得甘油,试仿照题目中合成流程图的形式,写出这一合成过程:____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题14物质结构与性质选考练习卷(解析版) 题型:填空题
下表为周期表的一部分,其中的编号代表对应的元素。

试填空。
(1)写出上表中元素I的基态原子的电子排布式和价层电子排布图:________________________________________________________________________。
元素C、D、E、F的第一电离能由大到小的顺序是________(用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有________。
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)5的配位化合物,该物质常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂。据此可判断:
①该化合物的晶体类型为________。
②该化合物的晶体中存在的作用力有________。
A.离子键 B.极性键
C.非极性键 D.范德华力
E.氢键 F.配位键
③根据共价键理论和等电子体理论分析,CE分子中σ键与π键的数目比为________。
(4)在测定A与F形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是________________________________________________。
(5)某些不同族元素的性质也有一定的相似性,如表中元素G与元素B,原因是_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题13化学实验综合应用练习卷(解析版) 题型:实验题
某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
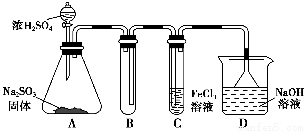
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在________中,再加水稀释,这样操作的目的是________,操作中不需要的仪器有________(填入正确选项前的字母)。
a.药匙 b.烧杯 c.石棉网 d.玻璃棒 e.坩埚
(2)通入足量SO2时,C中观察到的现象为______________________________。
(3)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:___________________________;
②请设计实验方案检验有Fe2+生成:__________________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法________(填“合理”或“不合理”),理由是_______________________________________________________________。
(4)D装置中倒置漏斗的作用是______________________________________。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填入正确选项前的字母)。
a.浓H2SO4 b.酸性KMnO4溶液
c.碘水 d.NaCl溶液
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题12化学实验基础练习卷(解析版) 题型:选择题
海洋中有丰富的食品、矿产、能源、药物和水产资源,对今后世界经济发展有着决定性作用。下列有关说法正确的是 ( )。
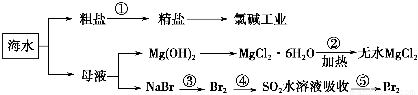
A.整个过程可在实验室中模拟进行
B.工段②是风化过程
C.在工段③④⑤中溴元素均被氧化
D.工段①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题11常见有机化合物及其应用练习卷(解析版) 题型:选择题
下列除去杂质(括号内为杂质)的方法正确的是( )。
①乙烷(乙烯)光照条件下通入Cl2,气液分离 ②乙酸乙酯(乙酸)用饱和碳酸钠溶液洗涤、分液 ③苯(乙酸)用氢氧化钠溶液洗涤、分液 ④乙醇(乙酸)加足量生石灰、蒸馏
A.①②③ B.②③④ C.①③④ D.①②④
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 4-1-2海水资源的开发利用练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.海水中含量最高的元素是氯
B.海水中含量最高的物质是氯化钠
C.加碘食盐溶液遇淀粉溶液显蓝色
D.加碘食盐中的碘是含碘元素的化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com