
某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
① 缓慢向烧瓶中(见图)通入过量混合气进行“浸锰”操作,主要反应原理为: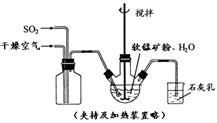
SO2+ H2O = H2SO3
MnO2+ H2SO3 = MnSO4+ H2O
(铁浸出后,过量的SO2 会将Fe3+还原为Fe2+)
② 向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末。
③ 再用Na2CO3溶液调节pH为3.5左右,过滤。
④ 调节滤液pH为6.5~7.2 ,加入NH4HCO3 ,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
回答:
(1)“浸锰”反应中往往有副产物MnS2O6 的生成,温度对“浸锰”反应的影响如下图,为减少MnS2O6的生成,“浸锰”的适宜温度是 。
(2)查阅表1,③中调pH为3.5时沉淀的主要成分是 。②中加入一定量纯MnO2粉末的主要作用是 ,相应反应的离子方程式为 。
表1:生成相应氢氧化物的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(12分)
(1)150℃ (或150℃以上)(1分)
(2) Fe(OH)3 (1分)
将Fe2+氧化为Fe3+,将过量的SO2氧化除去(2分)
MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O , MnO2+SO2 = Mn2+ + SO42- (2分)
(3)MnS(s) Mn2+(aq)+S2-(aq)
Mn2+(aq)+S2-(aq)
生成的CuS比MnS更难溶,促进MnS不断溶解,平衡右移,使Cu2+除去。(2分)
(4)Mn2++2HCO3-=MnCO3↓+CO2↑+H2O (2分)
(5)取少量最后一次洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净;反之则未洗干净。(2分)(其他答案合理,给分)
解析试题分析:(1)根据图1和图2,150℃以上时,副产物MnS2O6 的生成率低,Mn2+ 的浸出率高,答案:150℃ (或150℃以上)(1分)
(2)pH在2.7到3.5之间时沉淀主要成分是Fe(OH)3 ,答案:Fe(OH)3 1分)
Fe2+ 在pH为7.6到9.6之间沉淀,而此时Mn2+ 也产生沉淀,无法分离,故要将Fe2+ 氧化成Fe3+ 以便在pH小于8.7时沉淀,与Mn2+ 分离,故答案:将Fe2+氧化为Fe3+,将过量的SO2氧化除去(2分)
MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O , MnO2+SO2 = Mn2+ + SO42- (2分)
(3)Cu2+ +MnS Mn2++CuS,沉淀的转化,由溶解度较大的MnS转化为溶解度较小的CuS,原理见答案。答案:
Mn2++CuS,沉淀的转化,由溶解度较大的MnS转化为溶解度较小的CuS,原理见答案。答案:
MnS(s) Mn2+(aq)+S2-(aq)
Mn2+(aq)+S2-(aq)
生成的CuS比MnS更难溶,促进MnS不断溶解,平衡右移,使Cu2+除去。(2分)
(4)④中加入NH4HCO3 后发生反应的产生MnCO3沉淀,离子方程式为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O ,答案:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O (2分)
(5)检验④中沉淀是否洗涤干净,就是检验洗涤液中有无SO42―,答案为:取少量最后一次洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净;反之则未洗干净。(2分)(其他答案合理,给分)
考点:应用化学反应原理解决化工生产中的实际问题


科目:高中化学 来源: 题型:填空题
(1)某工厂每天要烧掉含硫1.6%的烟煤200 t,排放出的SO2会严重污染环境,如果变废为宝,将这些SO2回收利用,那么理论上每年(按365 d计)可生产98%的浓硫酸 吨;
(2)若要在铁制件表面镀镍,则镍应与电源的 极相连,电镀液可以用硫酸镍溶液,电镀过程中硫酸镍溶液的浓度会 (填“增大”“减小”或“不变”);
(3)工业上制造水泥、玻璃时都要用到的原料是 (填编号),用所选原料制玻璃的化学方程式是 ;
| A.纯碱 | B.熟石灰 | C.石灰石 | D.黏土 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下: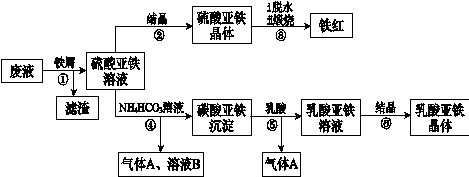
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是 。
步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、 。
(1)步骤④的离子方程式是 。
(1)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及 。
(1)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为 。
(1)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因 。
(1)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol?L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是工业上生产碳酸锂的部分工艺流程,请根据流程图及已知信息回答问题。
②
③几种物质不同温度下的溶解度。
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。写出图中①、②、③表示的各物质,步骤II中反应的离子方程式是 。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3,写出生成滤渣2反应的离子方程式:
。
(3)向滤液2中加入饱和Na2CO,溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
①将粗产品Li2CO3溶于盐酸作用解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解。阳极的电极反应式是 。
②电解后向产品LiOH溶液中加入过量NH4HCO,溶液生成Li2CO3反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图。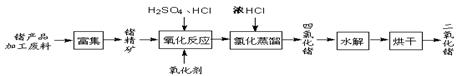
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式 。
(2)蒸馏可获GeCl4,在此过程中加入浓盐酸的原因是 。
(3)GeCl4水解生成GeO2·nH2O,化学方程式为 。温度对GeCl4的水解率产生的影响如图1所示,其原因是该水解反应ΔH 0(“>”或“<”)。为控制最佳的反应温度,实验时可采取的措施为 水浴。
A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)已知Ge的单质和化合物性质与Al的相似,试用离子方程式表示在pH>8的溶液中GeO2逐渐溶解时发生的反应 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
金属锂是原子能工业和新能源工业中的重要物质。工业上常用β—辉锂矿(主要成分是LiAlSi2O6,含有少量钙、镁杂质)制备金属锂,其生产流程如下:
已知Li2CO3微溶于水。请回答下列问题:
(1)写出LiAlSi2O6与硫酸反应的化学方程式_______________________。
(2)沉淀B的主要成分是_____________(写化学式)。
(3)蒸发浓缩Li2SO4溶液时,需要使用的硅酸盐质仪器有蒸发皿、_________和_________。
(4)上述生产流程中蒸发浓缩Li2SO4溶液的目的是____________________。
(5)金属锂用于锂电池时,常用FeF3作其正极的活性物质,FeF3常用FeCl3与40%HF溶液反应制备。在制备过程中需要选用特制聚四氟乙烯材料的容器进行反应,而不是用普通的玻璃仪器或陶瓷仪器,其原因是_________________________________(用化学反应方程式表示)。
(6)金属锂可用于储存氢气,其原理是:①2Li+H2=2LiH,②LiH+H2O=LiOH+H2↑。若已知LiH的密度为0.82g·cm-3,用金属锂吸收224L H2(标准状况)恰好完全反应,则生成的LiH的体积与被吸收的氢气的体积之比为1: ______(精确到整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
充分利用能源、提高原子利用率、减少向环境排放废弃物等都是绿色化学的基本要求。①在有机实验中,用溴的四氯化碳溶液代替溴的水溶液;②用稀硝酸代替浓硝酸溶解、回收银镜试管中的银;③用水浴加热代替直接用酒精灯加热;④接触法制硫酸中采用“热交换器”,利用余热预热冷原料气和烧水;⑤工业合成氨中分离产物得到氢气和氮气再循环使用;⑥电解法冶炼钠和镁,选择电解氯化钠和氯化镁,不电解对应的金属氧化物。上述主要不是从绿色化学角度考虑的是( )
| A.①③ | B.②④ | C.⑤⑥ | D.③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0,下列说法正确的是( )。
2NH3(g) ΔH<0,下列说法正确的是( )。
| A.达到平衡时反应物和生成物浓度一定相等 |
| B.达到平衡后加入氨气,重新达到平衡时,氨气的浓度比原平衡时大 |
| C.达到平衡时,升高温度加快了吸热反应的速率,降低了放热反应的速率,所以平衡向逆反应的方向移动 |
| D.加入催化剂可以缩短到达平衡的时间,这是因为加快了正反应的速率,而减慢了逆反应的速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com