
回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图。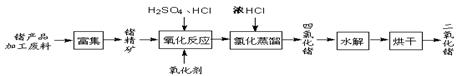
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式 。
(2)蒸馏可获GeCl4,在此过程中加入浓盐酸的原因是 。
(3)GeCl4水解生成GeO2·nH2O,化学方程式为 。温度对GeCl4的水解率产生的影响如图1所示,其原因是该水解反应ΔH 0(“>”或“<”)。为控制最佳的反应温度,实验时可采取的措施为 水浴。
A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)已知Ge的单质和化合物性质与Al的相似,试用离子方程式表示在pH>8的溶液中GeO2逐渐溶解时发生的反应 。
(15分)
(1)Ge2++H2O2+2H+=Ge4++2H2O (3分) (2)抑制GeCl4水解 (2分)
(3)GeCl4+ (2+n) H2O = GeO2·nH2O+ 4HCl (3分) < (2分) C (2分)
(4) GeO2+2OH-=GeO32—+H2O (3分)
解析试题分析:(1)锗元素由+2升为+4价,说明Ge2+是还原剂,过氧化氢是氧化剂,所含氧元素由—1降为—2,根据最小公倍数法配平,则该反应为Ge2++H2O2+2H+=Ge4++2H2O;(4)锗位于金属元素与非金属元素交界位置,因此推断它与铝相似,则GeCl4是强酸弱碱盐,蒸馏时加入盐酸能抑制它水解,防止转变为GeO2;(3)根据盐类水解原理,1mol GeCl4与4molH2O完全水解生成1molGe(OH)4和4molHCl,1molGe(OH)4受热分解生成1mol GeO2和2molH2O,由此可得GeCl4+ (2+n) H2O = GeO2·nH2O+ 4HCl;读图,相同时间内,随着反应温度的升高,水解率减小,前者使平衡向吸热反应方向移动,后者说明平衡向逆反应方向,则逆反应是吸热反应,由于正、逆反应的反应热恰好相反,则正反应是放热反应,因此该水解反应的焓变小于0;根据实验目的,为了制取更快、更多地制备GeO2·nH2O,应选择的温度为—12℃,由于冰水混合物的温度为0℃,盐可以降低水的凝固点,则冰盐水的温度低于0℃,因此只有C项正确;(4)根据相似类推,Al2O3与强碱溶液反应的原理为Al2O3+2OH—=2AlO2—+H2O,由此推断在碱性溶液反应生成锗酸盐和水,即 GeO2+2OH-=GeO32—+H2O。
考点:考查物质制备工艺流程,涉及氧化还原反应、离子方程式、盐类水解原理的应用、化学方程式、温度对化学平衡的影响、放热反应、吸热反应、焓变的正负、温度控制的方法及原理、元素化合物的性质、类比或仿写等。


科目:高中化学 来源: 题型:填空题
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列问题:
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入 (填设备名称),其主要目的是 。
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图1)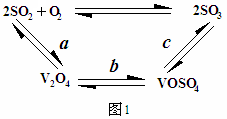
其中a、c二步反应的化学方程式可表示为: 、 。
(3)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(P)的关系如图2所示,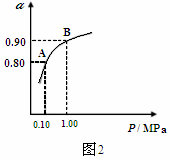
则:将2.0mol SO2和1.0mol O2置于5L密闭容器中,反应达平衡后,体系总压强为0.10M Pa,A与B表示不同压强下的SO2转化率,通常情况下工业生产中采用常压的原因是: 。
(4)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣,查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如图如下: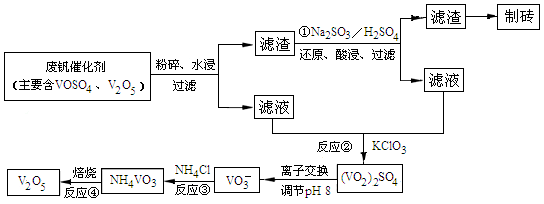
则反应①②③④中属于氧化还原反应的是 (填数字序号),反应①的离子方程式为 ,该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数和温度: 、 。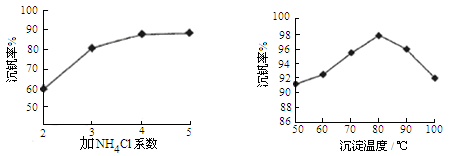
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(1)① TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________;
② 检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:
(2)Fe2O3与H2SO4反应的离子方程式是 。
(3)甲溶液中除含TiO2+之外还含有的金属阳离子有 。
(4)加Fe的作用是 。
Ⅱ.二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
反应②的方程式是 ,该反应需要在Ar气氛中进行,请解释原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧—钠氧化法”回收Na2Cr2O7等物质。
已知:水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等物质
(1)水浸后的溶液呈____性(“酸”、“碱”、“中”)。
(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式:
____Cr(OH)3+____Na2CO3+_____  = ____Na2CrO4+___CO2+_____
= ____Na2CrO4+___CO2+_____
(3)滤渣II的主要成分有Zn(OH)2、___________________________________。
(4)“系列操作”中为:继续加入H2SO4,________冷却结晶,过滤。继续加入H2SO4目的是________________________。
已知:①除去滤渣II后,溶液中存在如下反应:2CrO42ˉ+2H+ Cr2O72ˉ+H2O
Cr2O72ˉ+H2O
②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
| 温度 化学式 | 20℃ | 60℃ | 100℃ |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
| Na2CrO4 | 84 | 115 | 126 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池的电极材料。某化工厂以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如下: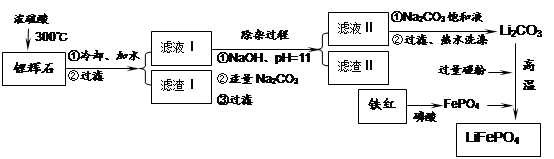
已知:2LiAl(SiO3)2 + H2SO4(浓) 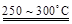 Li2SO4 + Al2O3·4SiO2·H2O↓
Li2SO4 + Al2O3·4SiO2·H2O↓
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
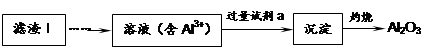
 LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应: 。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为 。
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应: 。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为 。查看答案和解析>>
科目:高中化学 来源: 题型:问答题
某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
① 缓慢向烧瓶中(见图)通入过量混合气进行“浸锰”操作,主要反应原理为: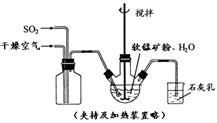
SO2+ H2O = H2SO3
MnO2+ H2SO3 = MnSO4+ H2O
(铁浸出后,过量的SO2 会将Fe3+还原为Fe2+)
② 向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末。
③ 再用Na2CO3溶液调节pH为3.5左右,过滤。
④ 调节滤液pH为6.5~7.2 ,加入NH4HCO3 ,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
回答:
(1)“浸锰”反应中往往有副产物MnS2O6 的生成,温度对“浸锰”反应的影响如下图,为减少MnS2O6的生成,“浸锰”的适宜温度是 。
(2)查阅表1,③中调pH为3.5时沉淀的主要成分是 。②中加入一定量纯MnO2粉末的主要作用是 ,相应反应的离子方程式为 。
表1:生成相应氢氧化物的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列物质的工业制备原理的方程式书写正确的是
A.氢氧化钠:Na2CO3+Ca(OH)2 CaCO3↓+2NaOH CaCO3↓+2NaOH |
B.乙醇:C6H12O6 2C2H5OH+2CO2↑ 2C2H5OH+2CO2↑ |
C.二氧化硫:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O CuSO4+SO2↑+2H2O |
D.氯气:Ca(ClO)2+4HCl(浓) CaCl2+2Cl2↑+2H2O CaCl2+2Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列物质的制备,符合工业生产实际的是( )
| A.将氯气通入澄清石灰水中制漂白粉 |
| B.用离子交换膜法电解饱和食盐水制备烧碱、氢气和氯气 |
| C.将氢气和氯气混合后点燃,产物用水吸收制备盐酸 |
| D.将SO2和O2的混合气加高压后,通过接触室,制备SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于可逆反应N2(g)+3H2(g) 2NH3(g)(正反应为放热反应),下列说法中正确的是( )。
2NH3(g)(正反应为放热反应),下列说法中正确的是( )。
| A.达到平衡后加入N2,当重新达到平衡时,NH3的浓度比原平衡的大,H2的浓度比原平衡也大 |
| B.达到平衡后,升高温度,既加快了正、逆反应的速率,又提高了NH3的产率 |
| C.达到平衡后,缩小容器的体积,既有利于加快正、逆反应速率,又有利于提高氢气的转化率 |
| D.加入催化剂可以缩短达到平衡的时间,是因为正反应速率增大了,逆反应速率减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com