
(10分)
(1)质量相同的O2、NH3、H2、Cl2四种气体中,在相同温度和相同压强条件下,体积最大的是 。
(2)下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是_______。(填序号)
①NaAlO2 ② Ca(OH)2 ③Na2CO3 ④Al(OH)3
(3)氯水中含有多种成分。将紫色石蕊试液滴入氯水中,溶液显红色起作用的成分是
;过一会儿,溶液颜色逐渐褪去,起作用的成分是 ;
(4)标准状况下把11.2L氯气通入500ml0.8mol/LFeBr2溶液中,写出反应完全后的离子方程式 。
(1) H2 (2)④ (3)HCl或H+、HClO
(4)5Cl2+4Fe2++6Br―=10Cl-+4Fe3++3Br2
解析试题分析:(1)质量相同的O2、NH3、H2、Cl2四种气体中,由V= ×Vm可知,质量相同时,气体体积与摩尔质量成反比,体积最大的是气体摩尔质量最小的,即氢气。
×Vm可知,质量相同时,气体体积与摩尔质量成反比,体积最大的是气体摩尔质量最小的,即氢气。
(2)物质中即与酸反应又与碱反应的主要有:特殊的单质(Al、Zn、Cl2、S、Si 等)、两性化合物(ZnO、AI2O3、Al(OH)3等)、弱酸的酸式盐(NaHS、NaHCO3等)、弱酸的铵盐(NH4)2CO3等)、部分化合物(SO2、NO2等)、氨基酸。
(3)氯水溶液中存在反应:Cl2+H2O?HCl+HClO,是可逆反应,存在电离:H2O H++OH-、HClO
H++OH-、HClO H++ClO-,HCl═H++Cl-,所以溶液中存在的微粒有:分子:Cl2、HClO、H2O;离子:H+、Cl-、ClO-、OH-。酸能使紫色石蕊试液变红色,在水溶液里电离出的阳离子全部是氢离子的是酸,所以使紫色石蕊试液变红色的微粒是氢离子;次氯酸有漂白性,所以红色溶液逐渐褪色,起作用的微粒是次氯酸分子。
H++ClO-,HCl═H++Cl-,所以溶液中存在的微粒有:分子:Cl2、HClO、H2O;离子:H+、Cl-、ClO-、OH-。酸能使紫色石蕊试液变红色,在水溶液里电离出的阳离子全部是氢离子的是酸,所以使紫色石蕊试液变红色的微粒是氢离子;次氯酸有漂白性,所以红色溶液逐渐褪色,起作用的微粒是次氯酸分子。
(4)将a mol Cl2通入含b mol FeBr2的溶液中,还原性Fe2+>Br―,所以通入氯气,Fe2+先被氯气氧化,反应完后再通氯气,Br―被氧化。所以当0< a / b≤1/2时,只有Fe2+被氧化,所以发生反应2Fe2++Cl2 =2Fe3++2Cl-;当 a / b =1时,Fe2+全部被氧化,Br―是Fe2+的2倍,只有1半被氧化,所以发生的反应方程式为2Cl2+2Fe2++2Br―= 2Fe3++Br2+4Cl―;当a / b≥3/2时,Fe2+、Br―全部被氧化,所以反应为3Cl2+2Fe2++4Br―=2Fe3++2Br2+6Cl―。标准状况下把11.2L氯气物质的量是0.5mol,500ml0.8mol/LFeBr2物质的量是0.4mol,氯气与FeBr2的物质的量比是5:4,介于1/2和3/2之间,Fe2+全部被氧化,Br―有剩余所以氯气与Fe2+全部反应完,得5Cl2+4Fe2++Br― Fe3++Br2+Cl―,根据电荷守恒和原子守恒既得5Cl2+4Fe2++6Br―=10Cl-+4Fe3++3Br2。
Fe3++Br2+Cl―,根据电荷守恒和原子守恒既得5Cl2+4Fe2++6Br―=10Cl-+4Fe3++3Br2。
考点:考查阿伏伽德罗定律,氯水的性质等。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:填空题
某同学购买了一瓶××牌“84消毒液”,查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25%NaClO 1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________ mol·L-1。
(2)该同学取100 mL该“84消毒液”稀释后用于消毒,稀释后的溶液中
c(Na+)=________ mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)某实验需用480 mL含25%NaClO的消毒液。该同学参阅该“84消毒液”的配方,欲用NaClO固体配制该消毒液。
①下列说法正确的是________。
A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
②在配制过程中,下列操作可能使配制的溶液的浓度偏大的是________。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)下列实验操作或对实验事实的描述不正确的是________(填序号)。
A.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出
D.用托盘天平称量11.74 g氯化钠晶体
E.用结晶法分离硝酸钾和氯化钠的混合物
(2)实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
①如图所示的仪器中配制溶液肯定不需要的是________(填序号);配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。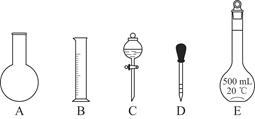
②下列操作中,容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
③请计算需用托盘天平称取固体NaOH的质量为________g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,烧杯的实际质量为________g。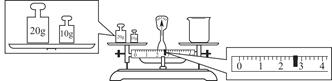
④根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知:①标准状况下,1体积水中最多能溶解500体积的HCl;
②饱和NaCl溶液的浓度约为5.00 mol·L-1。
在标准状况下,将448LHCl气体溶于1 L水中,所得溶液A的密度为1.20 g·cm-3,则溶液A中HCl的物质的量浓度为 。(本题计算结果均取三位有效数字)
(1)若使Cl-浓度与溶液A中的Cl-浓度相等,则在1 L NaCl饱和溶液中还应溶解约 L标准状况下HCl气体 (溶液体积变化忽略不计)。
(2)取10.0mL溶液A稀释成500mL溶液B,则溶液B中HCl的物质的量浓度为 。
(3)在溶液B的配制过程中,使用前必须检查是否漏液的仪器有 ;下列配制操作,造成溶液B浓度偏低的是_______________(选填序号)。
a.容量瓶用蒸馏水洗涤后未干燥
b.量取溶液A的量筒用蒸馏水洗涤后未干燥
c.定容时,俯视液面加水至刻度线
d.加水定容时液面不慎超过刻度线,立即用胶头滴管吸出部分水使液面刚好达刻度线
e.烧杯中溶液移入容量瓶后,未用水洗涤烧杯和玻璃棒即定容
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)环境专家认为可以用铝将水中的NO3﹣ 转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH﹣、Al(OH)3、NO3﹣、N2,请将各粒子分别填入以下空格(请将整个方程式配平后写在答题纸上).
NO3﹣+ + → + + ﹣ 该反应过程中,被氧化与被还原的元素的物质的量之比为 .
(2)若4Al(s)+3O2(g)=2Al2O3(s)△H=﹣a KJ/mol
Fe2O3(s)+C(s)=CO2(g)+2Fe (s)△H="+b" KJ/mol
C(s)+O2(g)=CO2(g)△H=﹣c KJ/mol
写出Al与氧化铁发生铝热反应的热化学方程式: .
(3)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL PH=14的溶液,然后用2mol/L的盐酸滴定,可得到沉淀量与消耗的盐酸体积关系如图:则反应过程中产生氢气的总体积为 L(标准状况)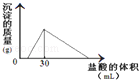
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某同学帮助水质检测站配制1000mL 1 mol·L-1NaOH溶液以备使用。
(1)该同学应选择___________mL的容量瓶。
(2)其操作步骤如下图所示,则如图操作应在下图中的 (填选项字母)之间。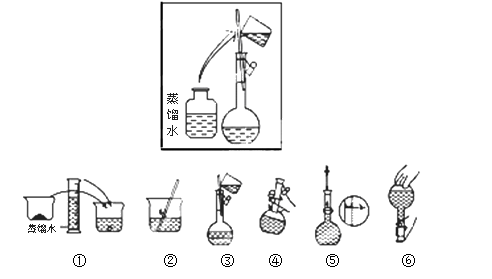
A.②与③ B.①与② C.④与⑤
(3)该同学应用托盘天平称取NaOH固体 g,用质量为33.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在下图中选出能正确表示游码位置的选项 (填选项字母)。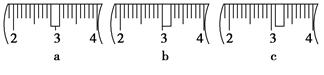
(4)下列操作对所配溶液的浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,俯视读数,浓度会 ;
②转移溶液过程中,少量液体溅出来,浓度会 ;
③容量瓶未干燥,浓度会 ;
④定容摇匀后发现溶液凹面低于刻度线,浓度会 。
(5)配制溶液的实际操作过程中,动作要快,否则由于 ,会使配制的NaOH溶液的浓度比1 mol·L-1 (填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 | 质量(g) | 摩尔质量(g·mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.87 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.075 | 170 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com