
����Ŀ��(1)������һ�ַ�����硢�ŵ��װ�á���һ�������ڳ��ͷŵ�ʱ�����ķ�Ӧ���£�NiO2��Fe��2H2O![]() Fe(OH)2��Ni(OH)2��
Fe(OH)2��Ni(OH)2��
�ٴ������ڳ��ʱ����ظ���Ӧ����ӵ�Դ��___�����ӣ��缫��ӦʽΪ__________��
�ڷŵ�ʱ����Ni(OH)2��һ�����ڳ��ʱ����_______��Ӧ(����������������ԭ��)
(2)����ͼ��ʾװ�ý������в�ͬ�IJ���
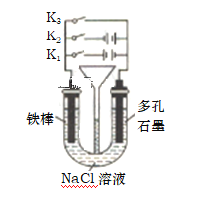
�ٽ�K1 ��K2�� K3�ֱ�ֻ�ر�һ���������ĸ�ʴ���ٶ�������ֻ�պ�_____(����K1���� ��K2������K3������ͬ)��Ϊ�������ĸ�ʴ�� ֻ�պ�_____���÷�������Ϊ__________________________��
��ֻ�պ�K3����������������5.6gʱ��ʯī�缫���ĵ��������Ϊ__________L(��״��)��
���𰸡��� Fe (OH)2��2 e����Fe��2OH�� ���� K1 K2 ��ӵ�Դ����������(�������籣����) 1.12L
��������
��1���ٴ������ڳ��ʱ����ظ���Ӧ����ӵ�Դ�ĸ����������������õ��ӷ�����ԭ��Ӧ��
�ڸ��ݵ���ܷ�ӦNiO2��Fe��2H2O![]() Fe(OH)2��Ni(OH)2�У���ŵ������Ni�Ļ��ϼ������仯���жϵ缫�����ķ�Ӧ���͡�
Fe(OH)2��Ni(OH)2�У���ŵ������Ni�Ļ��ϼ������仯���жϵ缫�����ķ�Ӧ���͡�
��2����ֻ�պ�K1Ϊ���أ�������������ʧ���������������ӣ����ڵ�Դ�����ṩ���ӣ����缫��ʴ�Ͽ죻ֻ�պ�K2Ϊ���أ�������������������������ʴ��ֻ�պ�K3Ϊԭ��أ�������������ʧȥ���������������ӷ���������ʴ�������ĸ�ʴ���ٶ�������ֻ�պ�K1��ֻ�պ�K2Ϊ���أ�������������������������ʴ���÷�������Ϊ��ӵ�Դ��������������
��ֻ�պ�K3Ϊԭ��أ�������������ʧȥ���������������ӷ���������ʴ���缫��ӦΪ��Fe-2e-= Fe2+����������������5.6gʱ�������Ӧ���������ʵ���������������0.1mol����ת��0.2mol���ӣ�ʯī�缫�ϣ������õ�����ˮ��Ӧ�������������ӣ��缫��ӦΪ��2H2O+O2+4e-=4OH-�����ݵ�ʧ�����غ㣬ת��0.2mol�����������������ʵ���Ϊ![]() =0.05mol�����״���£�ʯī�缫���ĵ����������Ϊ0.05mol��22.4L/mol=1.12L��
=0.05mol�����״���£�ʯī�缫���ĵ����������Ϊ0.05mol��22.4L/mol=1.12L��
(1)�ٴ������ڳ��ʱ����ظ���Ӧ����ӵ�Դ�ĸ����������������õ��ӷ�����ԭ��Ӧ����ӦʽΪ��Fe(OH)2+2e-�TFe+2OH-��
�ʴ�Ϊ������Fe(OH)2+2e-�TFe+2OH-��
�ڸ��ݵ���ܷ�ӦNiO2��Fe��2H2O![]() Fe(OH)2��Ni(OH)2���ŵ�ʱNiO2ת��ΪNi(OH)2��Ni�Ļ��ϼ���+4�۽���Ϊ+2�ۣ��õ��ӷ�����ԭ��Ӧ���õ缫Ϊ�������ڳ��ʱ�õ缫�����ķ�ӦΪ�ŵ�ʱ������̣�������������Ӧ��
Fe(OH)2��Ni(OH)2���ŵ�ʱNiO2ת��ΪNi(OH)2��Ni�Ļ��ϼ���+4�۽���Ϊ+2�ۣ��õ��ӷ�����ԭ��Ӧ���õ缫Ϊ�������ڳ��ʱ�õ缫�����ķ�ӦΪ�ŵ�ʱ������̣�������������Ӧ��
����������
(2)��ֻ�պ�K1Ϊ���أ�������������ʧ���������������ӣ����ڵ�Դ�����ṩ���ӣ����缫��ʴ�Ͽ죻ֻ�պ�K2Ϊ���أ�������������������������ʴ��ֻ�պ�K3Ϊԭ��أ�������������ʧȥ���������������ӷ���������ʴ�������ĸ�ʴ���ٶ�������ֻ�պ�K1��ֻ�պ�K2Ϊ���أ�������������������������ʴ���÷�������Ϊ��ӵ�Դ��������������
��Ϊ��K1��K2����ӵ�Դ����������(�������籣����)��
��ֻ�պ�K3Ϊԭ��أ�������������ʧȥ���������������ӷ���������ʴ���缫��ӦΪ��Fe-2e-= Fe2+����������������5.6gʱ������������![]() =0.1mol����ת��0.2mol���ӣ�ʯī�缫�ϣ������õ�����ˮ��Ӧ�������������ӣ��缫��ӦΪ��2H2O+O2+4e-=4OH-�����ݵ�ʧ�����غ㣬ת��0.2mol�����������������ʵ���Ϊ
=0.1mol����ת��0.2mol���ӣ�ʯī�缫�ϣ������õ�����ˮ��Ӧ�������������ӣ��缫��ӦΪ��2H2O+O2+4e-=4OH-�����ݵ�ʧ�����غ㣬ת��0.2mol�����������������ʵ���Ϊ![]() =0.05mol�����״���£�ʯī�缫���ĵ����������Ϊ0.05mol��22.4L/mol=1.12L��
=0.05mol�����״���£�ʯī�缫���ĵ����������Ϊ0.05mol��22.4L/mol=1.12L��
����1.12L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2�� I2��һ���������ܷ�����Ӧ��H2(g)+I2(g)![]() 2HI(g)��1 mol H2 ��ȫ��Ӧ�ų� akJ��������֪��(a��b��c ��������)������˵������ȷ����
2HI(g)��1 mol H2 ��ȫ��Ӧ�ų� akJ��������֪��(a��b��c ��������)������˵������ȷ����
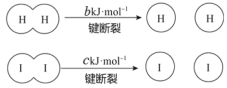
A.��Ӧ��������������������������
B.�Ͽ� 1 mol H��H ���� 1 mol I��I �������������ڶϿ� 2 mol H��I ����������
C.�Ͽ� 2 mol H��I ����������ԼΪ(c+b+a)kJ
D.���ܱ������м��� 2 mol H2 �� 2 mo l I2����ַ�Ӧ�ų�������С�� 2a kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ָ��������һ���ܴ���������ǣ� ��
A.ʹpH��ֽ����ɫ����Һ�У�Cu2+��NO![]() ��Fe3+��SO
��Fe3+��SO![]()
B.�����۷�Ӧ�ų���������ɫ��Һ�У�NO![]() ��Al3+��Na+��SO
��Al3+��Na+��SO![]()
C.pH=0����Һ�У�Al3+��NH![]() ��Ca2+��ClO-
��Ca2+��ClO-
D.ʹ��ɫʯ����ֽ��������Һ�У�SO![]() ��CO
��CO![]() ��Na+��K+
��Na+��K+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�������ܱ������д������·�Ӧ��![]()
![]() ����������������ʱ��ֻ�ı�ijһ���������ɵõ�����ͼ��
����������������ʱ��ֻ�ı�ijһ���������ɵõ�����ͼ��
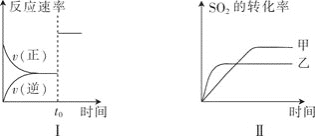
�������й���������ȷ����![]()
![]()
A.ͼ����Ա�ʾ![]() ʱ������
ʱ������![]() ��Ũ��
��Ũ��
B.ͼ����Ա�ʾ![]() ʱ�̼������
ʱ�̼������
C.ͼ����Ա�ʾ���ֲ�ͬѹǿ��![]() ��ת������ʱ��Ĺ�ϵ�����ҵ�ѹǿ�ȼ�
��ת������ʱ��Ĺ�ϵ�����ҵ�ѹǿ�ȼ�
D.ͼ����Ա�ʾ���ֲ�ͬ�¶���![]() ��ת������ʱ��Ĺ�ϵ���Ҽ��¶ȱ��Ҹ�
��ת������ʱ��Ĺ�ϵ���Ҽ��¶ȱ��Ҹ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ͼһ��ʾ���ǿ��淴ӦCO(g)��H2(g)![]() C(s)��H2O(g) ��H��0�Ļ�ѧ��Ӧ����(v)��ʱ��(t)�Ĺ�ϵ��ͼ����ʾ���ǿ��淴Ӧ2NO2(g)
C(s)��H2O(g) ��H��0�Ļ�ѧ��Ӧ����(v)��ʱ��(t)�Ĺ�ϵ��ͼ����ʾ���ǿ��淴Ӧ2NO2(g)![]() N2O4(g) ��H��0��Ũ��(c)��ʱ��(t)�ı仯���������˵������ȷ���ǣ� ��
N2O4(g) ��H��0��Ũ��(c)��ʱ��(t)�ı仯���������˵������ȷ���ǣ� ��

A. ��ͼһt2ʱ�ı������������ѹǿ����Ӧ����H����
B. ͼһt2ʱ�ı�������������������¶Ȼ�������ѹǿ
C. ͼ��t1ʱ�ı�������������������¶Ȼ�������ѹǿ
D. ��ͼ��t1ʱ�ı������������ѹǿ�����������ƽ����Է�����������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ��������ֱ���![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() �����е�������ɵĻ�������Է�������ͼת����
�����е�������ɵĻ�������Է�������ͼת����
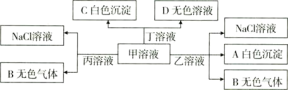
����˵���������![]()
![]()
A.��Ϊ![]()
B.�ܴ�����������Һ���е����ӣ�![]() ��
��![]() ��
��![]()
C.����Һ�����ӵĵ�����ϵ��![]()
D.����Һ�еμ���������Һ��Ӧ�����ӷ���ʽ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��M��N��O��P��Q��Ԫ�����ڱ���ԭ���������ε�����ǰ������Ԫ�أ�Mԭ������������Ϊ�ڲ��������3����N����ɫ��Ӧ�ʻ�ɫ��O���⻯����һ��ǿ�ᣬ��Ũ��Һ����M��Q�Ļ����ﷴӦ����O�ĵ��ʣ�P��һ�ֽ���Ԫ�أ����̬ԭ������6��δ�ɶԵ��ӣ���ش��������⣺
(1)Ԫ��Q������Ϊ______________��P�Ļ�̬ԭ�Ӽ۲�����Ų�ʽΪ__________________��
(2)O���⻯��ķе������һ����ͬ��Ԫ�ص��⻯��ͣ�����Ϊ___________________��
(3)M��O�縺�Դ�С˳����__________(��Ԫ�ط��ű�ʾ)��ʵ�����Ʊ�O���ʵĻ�ѧ����ʽ__________________________��
(4)M��N�γɵĻ�����ľ�����ͼ��ʾ���þ����ı߳�Ϊ a pm����þ�����ܶ�Ϊ____________________g/cm3

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�¶���CH3COOH��NH3��H2O�ĵ��볣����ȣ�����10 mLŨ��Ϊ0.1 mol��L-1��CH3COOH��Һ�еμ���ͬŨ�ȵİ�ˮ���ڵμӹ�����(����)
A.ˮ�ĵ���̶�ʼ������
B.��Һ�ĵ�������ʼ�ռ�С
C.c(CH3COOH)��c(CH3COO-)֮��ʼ�ձ��ֲ���
D.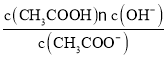 �ı�ֵ���ֲ���
�ı�ֵ���ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С����ʵ�����Ʊ��������������йذ���������̽����
![]() ��С��ͬѧ������ʯ�����Ȼ�淋Ļ������ȡ����İ�����
��С��ͬѧ������ʯ�����Ȼ�淋Ļ������ȡ����İ�����
![]() Ӧ��ѡ�õ�������װ����
Ӧ��ѡ�õ�������װ����![]() ����ĸ
����ĸ![]() ______ ��
______ ��
![]() ��ʯ�����Ȼ�立�Ӧ���ɰ����Ļ�ѧ����ʽΪ ______ ��
��ʯ�����Ȼ�立�Ӧ���ɰ����Ļ�ѧ����ʽΪ ______ ��
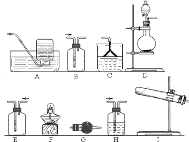
![]() ��С��ͬѧ�����ͼ��ʾװ��̽�������Ļ�ԭ�ԣ�
��С��ͬѧ�����ͼ��ʾװ��̽�������Ļ�ԭ�ԣ�

���������̻�ͬʱ���������Ӧ��д�����������û���Ӧ�Ļ�ѧ����ʽ ______ ![]() ��ʵ��ʱͨ�백�������ʹ��죬����ƿ�л���ְ��̣������ʵĻ�ѧʽΪ ______ ��
��ʵ��ʱͨ�백�������ʹ��죬����ƿ�л���ְ��̣������ʵĻ�ѧʽΪ ______ ��
![]() ��С��ͬѧ�����Ͷ�����̼Ϊԭ���Ʊ�̼����泥�
��С��ͬѧ�����Ͷ�����̼Ϊԭ���Ʊ�̼����泥�
![]() ��ͬѧ�Ƚ�������̼ͨ��ˮ�У�����ܽ����ͨ�백������ͬѧ�Ƚ�����ͨ��ˮ�У�����ܽ����ͨ�������̼�����ʵķ����� ______
��ͬѧ�Ƚ�������̼ͨ��ˮ�У�����ܽ����ͨ�백������ͬѧ�Ƚ�����ͨ��ˮ�У�����ܽ����ͨ�������̼�����ʵķ����� ______ ![]() ����������������
����������������![]() ��ԭ���� ______ ��
��ԭ���� ______ ��
![]() �����������
�����������![]() �ķ���Ϊ ______ ��
�ķ���Ϊ ______ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com