
【题目】在容积不变的密闭容器中存在如下反应:![]()
![]() 。在其他条件不变时,只改变某一个条件,可得到下列图像:
。在其他条件不变时,只改变某一个条件,可得到下列图像:
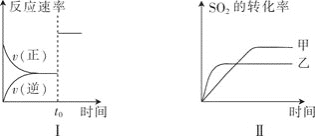
则下列有关叙述中正确的是![]()
![]()
A.图Ⅰ可以表示![]() 时刻增大
时刻增大![]() 的浓度
的浓度
B.图Ⅰ可以表示![]() 时刻加入催化剂
时刻加入催化剂
C.图Ⅱ可以表示两种不同压强下![]() 的转化率与时间的关系,且乙的压强比甲高
的转化率与时间的关系,且乙的压强比甲高
D.图Ⅱ可以表示两种不同温度下![]() 的转化率与时间的关系,且甲的温度比乙高
的转化率与时间的关系,且甲的温度比乙高
科目:高中化学 来源: 题型:
【题目】对达到平衡状态的可逆反应:A+B![]() C+D,若t1时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是()
C+D,若t1时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是()
A.A、B、C是气体,D不是气体B.C、D是气体,A、B有一种是气体
C.C、D有一种是气体,A、B都不是气体D.A、B是气体,C、D有一种是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铜转炉烟灰(主要成分ZnO还有Pb、Cu、Cd、As、Cl、F等元素)中回收锌、铜、铅等元素进行资源综合利用,具有重要意义。以铜转炉烟灰制备重要化工原料活性氧化锌的工艺流程如图所示。
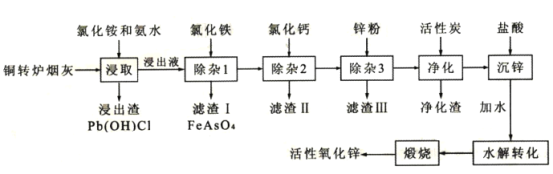
己知:活性炭净化主要是除去有机杂质。
请回答以下问题:
(1)若浸出液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___。
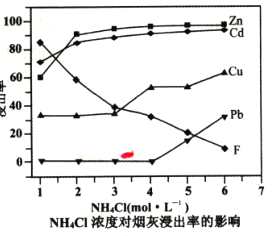
(2)在反应温度为50℃,反应时间为lh时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,结合流程图分析,氯化铵适宜的浓度为___ mo1·L-1。
(3)若浸出液中c(AsO43-)=6.0×10-3molL-1,现将8.0×10-3mo1L-1FeC13溶液与浸出液等体积混合生成砷酸铁沉淀。若该温度时Ksp(FeAsO4)=2.0×10-22,则反应后溶液中c(AsO43-)=___mo1L-1。
(4)滤渣II的主要成分为___;除杂3是置换除杂过程,则此过程主要除去的金属有___(填化学式)。
(5)沉锌得到的物质为Zn(NH3)2C12,请写出水解转化的化学方程式___。
(6)该流程中可以循环使用的物质的电子式为___。
(7)取mg活性氧化锌样品,预处理后配成待测液,加入指示剂3、4滴,再加入适量六亚甲基四胺,用amolL-1EDTA标准液进行滴定,消耗标准液VmL。己知:与1.0mLEDTA标准液[c(EDTA)=1.000mo1L-1]相当的以克表示的氧化锌质量为0.08139,则样品中氧化锌的质量分数为___(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是
A.SiF4和 CO![]() 的中心原子均为sp3杂化
的中心原子均为sp3杂化
B.![]() 此图错误,违背了泡利原理
此图错误,违背了泡利原理
C.凡中心原子采取sp3 杂化的分子,其 VSEPR 模型都是四面体
D.SO2为 V 形的极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】遵义市某些地区出现了不同程度的雾霾天气,我校课题小组的同学对其进行了调查研究,
Ⅰ.课题小组研究发现,其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。
(1)25℃时将PM2.5样本用蒸馏水处理制成待测溶液。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
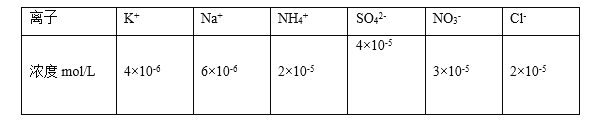
根据表中数据判断试样的pH=________。
Ⅱ.课题组就其酸性物质做进一步研究
一氧化氮、二氧化氮的研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应:
2NO(g)+O2(g) ![]() 2NO2(g),下列状态能说明该反应达到化学平衡的是_______(填字母编号)。
2NO2(g),下列状态能说明该反应达到化学平衡的是_______(填字母编号)。
A.混合气体的密度保持不变 B.NO的转化率保持不变
C.NO和O2的物质的量之比保持不变 D.O2的消耗速率和NO2的消耗速率相等
(2)活性炭可处理大气污染物NO,反应原理为:C(s)+2NO(g)![]() N2(g)+CO2(g),T℃时,在2L密闭容器中加入0.100mol NO和2.030mol活性炭(无杂质),平衡时活性炭物质的量是2.000mol,则该温度下的平衡常数为_________;达平衡时,若再向容器中充入0.04molNO,0.03molN2和0.03molCO2,则平衡________移动。(填“向左”“向右”或“不”)
N2(g)+CO2(g),T℃时,在2L密闭容器中加入0.100mol NO和2.030mol活性炭(无杂质),平衡时活性炭物质的量是2.000mol,则该温度下的平衡常数为_________;达平衡时,若再向容器中充入0.04molNO,0.03molN2和0.03molCO2,则平衡________移动。(填“向左”“向右”或“不”)
III.一氧化碳、二氧化碳的研究
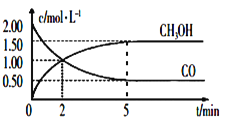
(1)CO或CO2在一定条件下可以用来合成甲醇。工业上常用CO和H2制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。从反应开始到5min,用H2表示的平均反应速率v(H2)=_____。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。从反应开始到5min,用H2表示的平均反应速率v(H2)=_____。
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △ H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △ H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △ H= - 178.3kJ/mol
①计算反应Ⅳ:C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=______kJ/mol;
CaCO3(s)+2H2(g)的△H=______kJ/mol;
对硫的氧化物的研究
②SO2可被Na2FeO4氧化而去除污染,工业上用Fe和石墨作电极电解浓NaOH溶液制备Na2FeO4。写出电解过程中阳极发生的电极反应________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:

(1)仪器a的名称是_______,仪器b的名称是_______。b中利用质量分数为70%80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______。c中试剂为_______
(2)实验中要控制SO2的生成速率,可以采取的措施有_______ (写出一条)
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-Fe(S2O3)33-(紫黑色)
装置 | 试剂X | 实验现象 |
| Fe2(SO4)3溶液 | 混合后溶液先变成紫黑色,30s后几乎变为无色 |
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______(填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅱ的现象:_______
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294gmol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为_______molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)蓄电池是一种反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应如下:NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
①此蓄电池在充电时,电池负极应与外加电源的___极连接,电极反应式为__________。
②放电时生成Ni(OH)2的一极,在充电时发生_______反应(填“氧化”或“还原”)
(2)按如图所示装置进行下列不同的操作
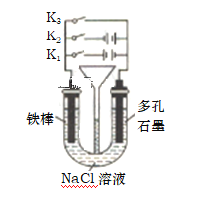
①将K1 、K2、 K3分别只关闭一个,则铁的腐蚀的速度最快的是只闭合_____(填“K1”或 “K2”或“K3”,下同),为减缓铁的腐蚀, 只闭合_____,该防护法称为__________________________。
②只闭合K3,当铁棒质量减少5.6g时,石墨电极消耗的气体体积为__________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如图(反应条件及其它产物已略去).下列说法不正确的是( )
![]()
A. 若甲是AlCl3溶液,则丁可能是NaOH溶液
B. 若甲是Fe,则丁可能是Cl2
C. 若丁是CO2,则甲可能为Mg
D. 若丁是O2,则乙、丙的相对分子质量可能相差16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) ΔH=57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g) ΔH=57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
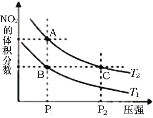
A.由状态B到状态A,可以用加热的方法
B.A、C两点气体的颜色:A深,C浅
C.A、C两点的反应速率:A>C
D.A、C两点气体的平均相对分子质量:A>C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com