
����Ŀ����ͭת¯�̻ң���Ҫ�ɷ�ZnO����Pb��Cu��Cd��As��Cl��F��Ԫ�أ��л���п��ͭ��Ǧ��Ԫ�ؽ�����Դ�ۺ����ã�������Ҫ���塣��ͭת¯�̻��Ʊ���Ҫ����ԭ�ϻ�������п�Ĺ���������ͼ��ʾ��
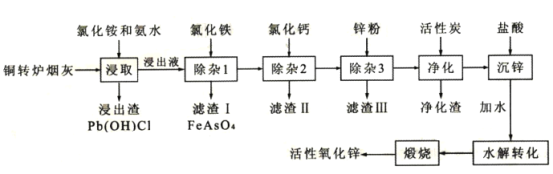
��֪������̿������Ҫ�dz�ȥ�л����ʡ�
��ش��������⣺
��1��������Һ��пԪ����[Zn(NH3)4]2+��ʽ���ڣ����ȡʱZnO������Ӧ�����ӷ���ʽΪ___��
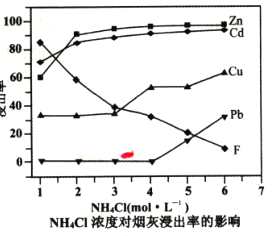
��2���ڷ�Ӧ�¶�Ϊ50�棬��Ӧʱ��Ϊlhʱ���ⶨ��Ԫ�صĽ��������Ȼ����ҺŨ�ȵĹ�ϵ��ͼ���������ͼ�������Ȼ�����˵�Ũ��Ϊ___ mo1��L-1��
��3��������Һ��c��AsO43-��=6.0��10-3molL-1���ֽ�8.0��10-3mo1L-1FeC13��Һ�����Һ�����������������������������¶�ʱKsp(FeAsO4)=2.0��10-22����Ӧ����Һ��c(AsO43-)=___mo1L-1��
��4������II����Ҫ�ɷ�Ϊ___������3���û����ӹ��̣���˹�����Ҫ��ȥ�Ľ�����___���ѧʽ����
��5����п�õ�������ΪZn(NH3)2C12����д��ˮ��ת���Ļ�ѧ����ʽ___��
��6���������п���ѭ��ʹ�õ����ʵĵ���ʽΪ___��
��7��ȡmg��������п��Ʒ��Ԥ��������ɴ���Һ������ָʾ��3��4�Σ��ټ����������Ǽ��İ�����amolL-1EDTA��Һ���еζ������ı�ҺVmL����֪����1.0mLEDTA��Һ[c(EDTA)=1.000mo1L-1]�൱���Կ˱�ʾ������п����Ϊ0.08139������Ʒ������п����������Ϊ___���ô���ʽ��ʾ����
���𰸡�ZnO+2NH4++2NH3H2O=[Zn(NH3)4]2++3H2O 4 2.0��10-19 CaF2 Cu��Cd Zn(NH3)2Cl2+2H2O=Zn(OH)2��+2NH4Cl 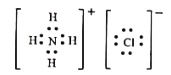
![]() ��100%��
��100%��![]() %
%
��������
�������Ȼ�狀Ͱ�ˮ��ȡ�̻ң���пԪ��ת��Ϊ![]() �����ӣ������Ȼ������飬�����Ȼ��ƿ��Եõ�
�����ӣ������Ȼ������飬�����Ȼ��ƿ��Եõ�![]() ������өʯ��������п�ۿ��Խ�������������ȫ���û������õ�����III���������̿��ȥ�л����ʣ��������Ὣпת��Ϊ
������өʯ��������п�ۿ��Խ�������������ȫ���û������õ�����III���������̿��ȥ�л����ʣ��������Ὣпת��Ϊ![]() �����õ�����п���ݴ����������⼴�ɡ�
�����õ�����п���ݴ����������⼴�ɡ�
��1��������Ŀ��Ϣ�����ӷ���ʽΪ![]() ��������̿��Դӵ���غ�ĽǶ�����ƽ��
��������̿��Դӵ���غ�ĽǶ�����ƽ��
��2���۲���ͼ�����Ȼ�淋�Ũ��Ϊ4mol/Lʱ��һ����пԪ�صĽ������Ѿ��ӽ�100%���������Ȼ��Ũ��û��̫�����壬��һ������Ũ���ٸߣ�ǦԪ�ؽ�������Һ������ȫ��ȥǦ��
��3���������Ϻ��൱���������ӵ�Ũ�ȶ���Ϊһ�룬��![]() ��
��![]() ��������������1:1�����ģ��跴Ӧ��
��������������1:1�����ģ��跴Ӧ��![]() Ũ��Ϊ
Ũ��Ϊ![]() ������
������![]() �����
�����![]() ��
��
��4�����ݷ���������IIΪ![]() ��������3��Ҫ���Գ�ȥ��Һ�е�
��������3��Ҫ���Գ�ȥ��Һ�е�![]() ��
��![]() ��
��
��5����Ȼ���պ�õ�![]() ��������ǰ��ȻΪ
��������ǰ��ȻΪ![]() ����ˮ�����Ϊ
����ˮ�����Ϊ![]() ���ݴ���д������ʽZn(NH3)2Cl2+2H2O=Zn(OH)2��+2NH4Cl��
���ݴ���д������ʽZn(NH3)2Cl2+2H2O=Zn(OH)2��+2NH4Cl��
��6��ˮ���õ����Ȼ�泥��ֿ������ڵ�һ���Ľ�ȡ������ѭ�����ã������ʽΪ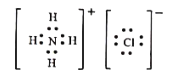 ��
��
��7������![]() �����EDTA��������Ϊ
�����EDTA��������Ϊ![]() ����ЩEDTA��Ӧ������п������Ϊ
����ЩEDTA��Ӧ������п������Ϊ![]() �ˣ��������п����������Ϊ
�ˣ��������п����������Ϊ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�ij��Ӧ�ﵽ�˻�ѧƽ�⣬�䷴Ӧ���̶�Ӧ�������仯��ͼ������˵����ȷ����
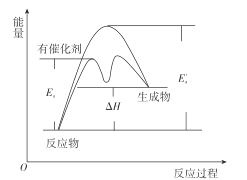
A.EaΪ���������¸÷�Ӧ�Ļ�ܣ�Ea��Ϊ����ʱ�÷�Ӧ�Ļ��
B.�÷�ӦΪ���ȷ�Ӧ����H=Ea-Ea��
C.�����������ϸߡ��п��ܷ�����Ч��ײ�ķ���
D.������ͨ�����ͷ�Ӧ����Ļ����ͬ�ȳ̶ȵ��������淴Ӧ���ʣ�ʹƽ�ⲻ�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʵ�����������⻯ѧ֪ʶ���γɻ�ѧ������̽���봴��������
��1���������Ͽ�֪��2KMnO4+16HCl��Ũ���T 2MnCl2 + 2KCl + 5Cl2�� + 2H2O��ijͬѧ���ͼ1��ʾװ�����Ʊ����������������������ʵ��װ�û��Լ��д������______
A �٢� B �� C �ڢ� D �٢�


��2����ͼ1װ������ȷ���������ռ�Cl2��װ�ã����ͼ2��ѡ�ú��ʵ�װ��__��
��3�����Ƶõ�Cl2��������ʵ�飬װ����ͼ3��ʾ������װ��ʡ�ԣ�����ش��������⡣

��װ��E�пɹ۲쵽____����Ӧ�Ļ�ѧ����ʽ____��
��װ��F�ڷ�Ӧ�е�������_____��
��װ��G���õ���Һ�о���Ư���Եķ�����___��
��װ��H������____��
��4����ҵƯ�۳���Cl2��ʯ���鷴Ӧ�Ƶã���Ӧ����ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������һ����Ҫ�Ļ�����Ʒ��ij��ȤС�����Ʊ���������ƾ��壨Na2S2O3��5H2O����
I.[��������]
��1��Na2S2O3��5H2O����ɫ�����壬������ˮ����ϡ��Һ��BaCl2��Һ����������ɡ�
��2����Na2CO3��Na2S���Һ��ͨ��SO2���Ƶ�Na2S2O3�����ò�Ʒ�г���������Na2SO3��Na2SO4��
��3��Na2SO3�ױ�������BaSO3������ˮ��������ϡHCl��
��.[�Ʊ���Ʒ]ʵ��װ����ͼ��ʾ��ʡ�Լг�װ�ã�

ʵ�鲽�裺
��1������B��D��������___����ͼʾ�����Լ���E�е��Լ���___��ѡ��������ĸ��ţ���
A.ŨH2SO4 B.����NaHSO3��Һ C.NaOH��Һ D.����ʳ��ˮ
��2������C����ƿ����Na2S��Na2CO3�����Һ������A����ƿ�μ�ŨH2SO4��C�з�Ӧ����Na2S2O3��CO2��д��C�з�Ӧ�����ӷ���ʽΪ___��
��3����Na2S��Na2CO3��ȫ���ĺ�����Ӧ������C�л��Һ����Һ��___����д�������ƣ������ˡ�ϴ�ӡ�����õ���Ʒ��
��.[̽���뷴˼]
��4��Ϊ��֤��Ʒ�к���Na2SO3��Na2SO4����С�����������ʵ�鷽�����뽫���������������������Լ���ϡHNO3��ϡH2SO4��ϡHCl������ˮ��ѡ��ȡ������Ʒ���ϡ��Һ���μ�����BaCl2��Һ���а�ɫ�������ɣ����ˣ�ϴ�ӣ�___��������δ��ȫ�ܽ⣬���д̼�����ζ��������������ȷ����Ʒ�к���Na2SO3��Na2SO4��
��5��Ϊ����װ��C�����ɵ�Na2SO4�������ڲ��ı�ԭ��װ�õĻ����϶�ԭ��ʵ����裨2�������˸Ľ����Ľ���IJ�����___��Ȼ������C����ƿ�������ƺ�̼���ƵĻ����Һ��
��6��̽��Na2S2O3�Ƿ���л�ԭ�ԣ���������ˮ�еμ�Na2S2O3��Һ����������ˮ��ɫ��dz������ɫ����˵���л�ԭ��(��֪��Na2S2O3��������Na2SO4������Ӧ�����ӷ���ʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Ҫ���л��
CH2=CH2 

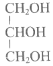
�� �� �� ��
��1��������Һ��ȼ�ϵ���________������ţ���ͬ����
��2�����������ƻ�ױƷ��ʪ�ɷֵ���________��
��3���������Ʊ���ȩ��֬����________��
��4�����������Ϊ����ʯ�ͻ�����չˮƽ�ı�־����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��������A��C4H10O����һ���л��ܼ���A���Է������±仯��
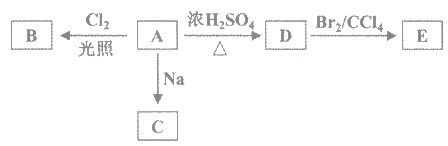
��1����Aֻ��һ��һ��ȡ����B��д����Aת��ΪB�Ļ�ѧ����ʽ_________��
��A��ͬ���칹��FҲ�����п�ͼ��A�ĸ��ֱ仯����F��һ��ȡ���������֡�F�Ľṹ��ʽ��____��
��2����������HQ����C6H6O2����������Ӱ������HQ�����������Ȼ�����Һ������ɫ��Ӧ����HQ����һ����ȡ����ֻ��һ�֣���HQ"�Ľṹ��ʽ________��
��3��A����HQ����һ��������������γ�ˮ��һ��ʳƷ����������TBHQ������TBHQ��������������Һ���õõ���ѧʽΪ��C10H12O2Na2���Ļ������TBHQ"�Ľṹ��ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2013��6�¡���Ȼ��������ԭ�ӽṹģ��100���ꡣ�����������ԭ�ӽṹ����ʶ���������Ƿdz���Ҫ�ġ����¹��������ԭ�ӽṹ����ʶ������ǣ�������

A. ��ķѷ���ֵ���
B. �������������ԭ��ѧ˵
C. ¬ɪ��ͨ��������ɢ��ʵ���ܽ��ԭ�ӽṹ���Ѹɲ���ģ��
D. �����״ν����ӻ�����Ӧ�õ�ԭ�ӽṹ����������ԭ���ȶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؾ���ṹ��˵����ȷ���ǣ� ��
A. ������������������ܶѻ��Ľṹ�У�ÿ�������к���2��ԭ��
B. ͨ��״���£�60 g SiO2�����к��еķ�����ΪNA��NA��ʾ�����ӵ�������
C. ����ͭ�ľ���Ϊ��������������������ÿ��ͭԭ�ӵ���λ��Ϊ6
D. 1 mol���ʯ��4 mol C��C�������ʯ��״�ṹ�У��ɹ��ۼ��γɵ�̼ԭ�ӻ�����С�Ļ�����6��̼ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A����Na2CO3 + SiO2 ![]() Na2SiO3 + CO2����֪������H2SiO3>H2CO3
Na2SiO3 + CO2����֪������H2SiO3>H2CO3
B���������Ҫ�ܷ����������IJ����Լ�ƿ��
C�����������Һ�м������������ɫ����������ʱ�����ܽ�
D����������������������������Ϊ�ڻ�NaOH�����װ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com