
【题目】(1)化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化:
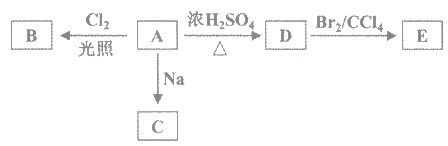
(1)①A只有一种一氯取代物B。写出由A转化为B的化学方程式_________。
②A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种。F的结构简式是____。
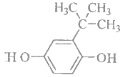
(2)化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与三氯化铁溶液发生显色反应。“HQ”的一硝基取代物只有一种,“HQ"的结构简式________。
(3)A与“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”。“TBHQ”与氢氧化钠溶液作用得到化学式为(C10H12O2Na2)的化合物。“TBHQ"的结构简式是____________。
【答案】 (CH3)2CHCH2OH
(CH3)2CHCH2OH ![]()
【解析】
化合物A(C4H10O)是一种有机溶剂,根据图知,D中含有不饱和键,能和溴发生加成反应,则A为醇、D为烯烃,A只有一种一氯取代物B,则A结构简式为(CH3)3COH,B为(CH3)2C(OH)CH2Cl,A和钠反应生成C,C为(CH3)3CONa,A发生消去反应生成D,D为CH2=C(CH3)2,D发生加成反应生成E,E为CH2BrCBr(CH3)2;
(1)①A为(CH3)3COH与氯气光照条件下生成B,方程式为 ;
;
答案:
②A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种,F的结构简式为(CH3)2CHCH2OH;
答案:(CH3)2CHCH2OH ;
(2)化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与三氯化铁溶液发生显色反应,说明含有酚羟基,同时含有苯环, “HQ”的一硝基取代物只有一种,说明两个酚羟基位于对位,结构简式为![]() ;
;
答案: ![]() ;
;
(3)A与“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”,“TBHQ”与氢氧化钠溶液作用得到化学式为C10H12O2Na2的化合物,则“TBHQ”中含有2个酚羟基,结合A、“HQ”的化学式可知,应(CH3)3COH与![]() 发生苯环取代反应脱去1分子水生成“TBHQ”,“TBHQ”结构简式为
发生苯环取代反应脱去1分子水生成“TBHQ”,“TBHQ”结构简式为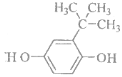 ;
;
答案:


科目:高中化学 来源: 题型:
【题目】某固体样品可能含有K+、Ca2+、NH4+、Cl-、CO32-、SO42-中的几种离子。将该固体样品分为等质量的两份,进行如下实验(不考虑盐类的水解及水的电离):(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀6.63g,在沉淀中加入过量稀盐酸,仍有4.66g沉淀。(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况)(假设气体全部逸出)。下列说法正确的是
A.该固体中一定含有NH4+、CO32-、SO42-、Cl-
B.该固体中一定没有Ca2+、Cl-,可能含有K+
C.该固体可能由(NH4)2SO4、K2CO3和NH4Cl组成
D.该固体中n(K+)≥0.06mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室以含镍废料(主要成分为NiO,还含有少量 FeO、Fe2O3、CoO、BaO 和SiO2)为原料制备NixOy 和碳酸钴(CoCO3)的工艺流程如图:
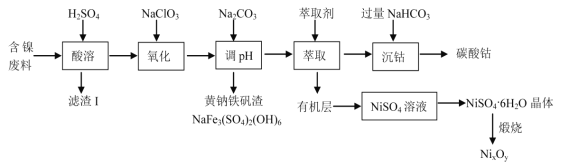
已知有关氢氧化物开始沉淀和沉淀完全的 pH 如表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Ni(OH)2 |
开始沉淀的 pH | 1.5 | 6.5 | 7.2 | 7.7 |
沉淀完全的 pH | 3.7 | 9.7 | 9.4 | 9.2 |
请回答以下问题:
(1)“滤渣Ⅰ”主要成分为(填化学式)_____。
(2)“氧化”时(加入 NaClO3)的离子方程式为_____。
(3)加入 Na2CO3 来“调 pH”的目的是生成黄钠铁钒沉淀而除去铁,也可通过加入MO(对应的金属氧化物)来调节 pH 将铁除去,则 pH 控制的范围为_____。
(4)在实验室萃取操作应该在_____中完成(填仪器名称),向水相中加入NaHCO3 时的离子方程式为_________。
(5)从 NiSO4 溶液获得NiSO4·6H2O 晶体的操作依次是:_____,_________,过滤,洗涤,干燥。“煅烧”时剩余固体质量与温度变化曲线如图,该曲线中 B 段所表示氧化物的名称为_____。
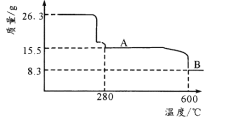
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某锂离子电池充电时的工作原理如图所示,LiCoO2中的Li+穿过聚内烯微孔薄膜向左迁移并嵌入石墨(C6表示)中。下列说法错误的是( )
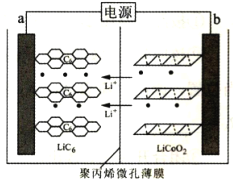
A.充电时,阳极电极反应式为LiCoO2-xe-=xLi++Lil-xCoO2
B.放电时,该电池将化学能转化为电能
C.放电时,b端为负极,发生氧化反应
D.电池总反应为LixC6+Lil-xCoO2![]() C6+LiCoO2
C6+LiCoO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铜转炉烟灰(主要成分ZnO还有Pb、Cu、Cd、As、Cl、F等元素)中回收锌、铜、铅等元素进行资源综合利用,具有重要意义。以铜转炉烟灰制备重要化工原料活性氧化锌的工艺流程如图所示。
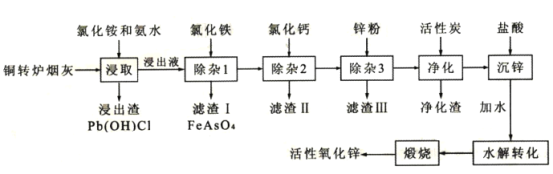
己知:活性炭净化主要是除去有机杂质。
请回答以下问题:
(1)若浸出液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___。
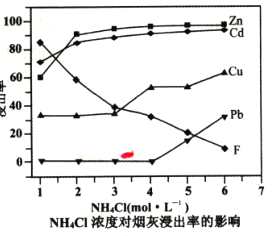
(2)在反应温度为50℃,反应时间为lh时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,结合流程图分析,氯化铵适宜的浓度为___ mo1·L-1。
(3)若浸出液中c(AsO43-)=6.0×10-3molL-1,现将8.0×10-3mo1L-1FeC13溶液与浸出液等体积混合生成砷酸铁沉淀。若该温度时Ksp(FeAsO4)=2.0×10-22,则反应后溶液中c(AsO43-)=___mo1L-1。
(4)滤渣II的主要成分为___;除杂3是置换除杂过程,则此过程主要除去的金属有___(填化学式)。
(5)沉锌得到的物质为Zn(NH3)2C12,请写出水解转化的化学方程式___。
(6)该流程中可以循环使用的物质的电子式为___。
(7)取mg活性氧化锌样品,预处理后配成待测液,加入指示剂3、4滴,再加入适量六亚甲基四胺,用amolL-1EDTA标准液进行滴定,消耗标准液VmL。己知:与1.0mLEDTA标准液[c(EDTA)=1.000mo1L-1]相当的以克表示的氧化锌质量为0.08139,则样品中氧化锌的质量分数为___(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚酰亚胺是综合性能最佳的有机高分子材料之一,已广泛应用在航空、航天、微电子等领域。某聚酰亚胺的合成路线如图(部分反应条件己略去):
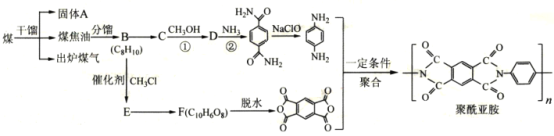
己知下列信息:
①芳香族化合物B的一氯代物有两种
②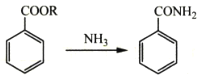
③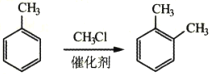
回答下列问题:
(1)固体A是___(写名称);B的化学名称是___。
(2)反应①的化学方程式为___。
(3)D中官能团的名称为___;反应②的反应类型是___。
(4)E的分子式为___;己知1mo1F与足量的NaHCO3反应生成4mo1CO2,则F的结构简式是___。
(5)X与C互为同分异构体,写出同时满足下列条件的X的结构简式___。
①核磁共振氢谱显示四种不同化学环境的氢,其峰面积之比为2:2:1:1
②能与NaOH溶液反应,1mo1X最多消耗4mo1NaOH
③能发生水解反应,其水解产物之一能与FeC13溶液发生显色反应
(6)参照上述合成路线,以甲苯和甲醇为原料(无机试剂任选)设计合成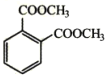 的路线___。
的路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是
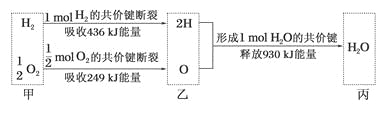
A.H2O分解为H2与O2时放出热量
B.1molH2与0.5molO2完全反应生成1mol H2O时放出热量245 kJ
C.甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙
D.氢气和氧气的总能量小于水的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R、P、Q是短周期主族元素,部分信息如下表所示:
X | Y | Z | W | R | P | Q | |
原子半径/nm | 0.154 | 0.074 | 0.099 | 0.075 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | -3,+5 | +3 | ||
其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为___。
(2)Z的单质与水反应的化学方程式是___;R与Q两元素最高价氧化物水化物反应的离子方程式___。
(3)Y与R相比,非金属性较强的是___(用元素符号表示),下列事实能证明这一结论的是___(填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)写出工业制取Y的单质的化学方程式___。
(5)反应3X2(g)+P2(g)![]() 2PX3(g)过程中的能量变化如图所示回答下列问题:
2PX3(g)过程中的能量变化如图所示回答下列问题:
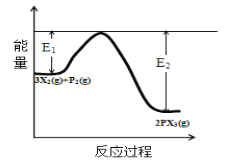
①该反应是___反应(填“吸热”“放热”);
②反应体系中加入催化剂对反应热是否有影响?___,原因是___(从能量说明)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C均为短周期元素,它们在周期表中的位置如图。已知B、C两元素在周期表中族序数之和是A元素序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组是( )
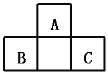
A.Be、Na、AlB.B、Mg、SiC.O、P、ClD.C、Al、P
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com