
【题目】根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是
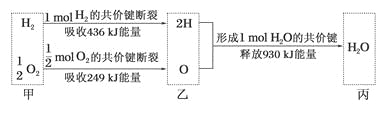
A.H2O分解为H2与O2时放出热量
B.1molH2与0.5molO2完全反应生成1mol H2O时放出热量245 kJ
C.甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙
D.氢气和氧气的总能量小于水的能量
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]实验装置如图所示(省略夹持装置)

实验步骤:
(1)仪器B和D的作用是___,按图示加入试剂,E中的试剂是___(选填下列字母编号)。
A.浓H2SO4 B.饱和NaHSO3溶液 C.NaOH溶液 D.饱和食盐水
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4,C中反应生成Na2S2O3和CO2,写出C中反应的离子方程式为___。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经___(填写操作名称)、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(4)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,洗涤,___,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(5)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验Ⅱ步骤(2)进行了改进,改进后的操作是___,然后再向C中烧瓶加入硫化钠和碳酸钠的混合溶液。
(6)探究Na2S2O3是否具有还原性:向新制氯水中滴加Na2S2O3溶液,若看到氯水颜色变浅(或褪色),说明有还原性(已知:Na2S2O3被氧化成Na2SO4),反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化:
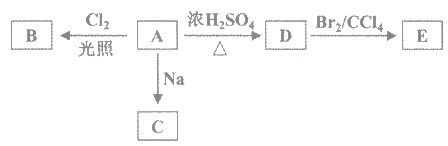
(1)①A只有一种一氯取代物B。写出由A转化为B的化学方程式_________。
②A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种。F的结构简式是____。
(2)化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与三氯化铁溶液发生显色反应。“HQ”的一硝基取代物只有一种,“HQ"的结构简式________。
(3)A与“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”。“TBHQ”与氢氧化钠溶液作用得到化学式为(C10H12O2Na2)的化合物。“TBHQ"的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年6月《自然》刊波尔原子结构模型100周年。波尔在人类对原子结构的认识的历程上是非常重要的。以下关于人类对原子结构的认识错误的是( )

A. 汤姆逊发现电子
B. 道尔顿提出近代原子学说
C. 卢瑟福通过α粒子散射实验总结出原子结构葡萄干布丁模型
D. 玻尔首次将量子化概念应用到原子结构,并解释了原子稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水FeCl2易吸湿、易被氧化,常作为超高压润滑油的成分。某实验小组利用无水FeCl3和氯苯(无色液体,沸点132.2℃)制备少量无水FeCl2,并测定无水FeCl2的产率。
实验原理:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑
2FeCl2+C6H4Cl2+HCl↑
实验装置:按如图所示组装好的装置,检查气密性后,向三颈烧瓶A中加入16.76g无水FeCl3和22.5g氯苯。
回答下列问题:

(1)利用工业氮气(含有H2O、O2、CO2)制取纯净干燥的氮气。
①请从下列装置中选择必要的装置,确定其合理的连接顺序:a→________→上图中的j口(按气流方向,用小写字母表示)。

②实验完成后通入氮气的主要目的是________。
(2)装置C中的试剂是________(填试剂名称),其作用是________。
(3)启动搅拌器,在约126℃条件下剧烈搅拌30min,物料变成黑色泥状。加热装置A最好选用__(填字母)。
a.酒精灯 b.水浴锅 c.电磁炉 d.油浴锅
(4)继续升温,在128~139℃条件下加热2h,混合物颜色逐渐变浅,黏度降低。该步骤中加热温度已经接近或超过氯苯沸点,但氯苯实际损失量却非常小,其原因是________。
(5)继续加热1h后放置冷却,在隔绝空气条件下过滤出固体,用洗涤剂多次洗涤所得固体,置于真空中干燥,得到成品。若D中所得溶液恰好与25mL2.0mol·L-1NaOH溶液完全反应,则该实验中FeCl2的产率约为________(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶体结构的说法正确的是( )
A. 金属晶体的体心立方密堆积的结构中,每个晶胞中含有2个原子
B. 通常状况下,60 g SiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数)
C. 金属铜的晶胞为面心立方晶胞,晶胞中每个铜原子的配位数为6
D. 1 mol金刚石含4 mol C—C键,金刚石网状结构中,由共价键形成的碳原子环,最小的环上有6个碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
Ⅰ.(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①基态Ni2+的核外电子排布式为_________________。
②在[Ni(NH3)6]2+中存在的化学键有(_____________)
A.离子键 B.共价键 C.配位键 D. 氢键 E.σ键 F.π键
Ⅱ.丁二酮肟是检验Ni2+的灵敏试剂。
(2)丁二酮肟分子![]() 中C原子轨道杂类型为________________,1mol丁二酮肟分子所含σ键的数目为_____________。
中C原子轨道杂类型为________________,1mol丁二酮肟分子所含σ键的数目为_____________。
(3)配合物[Ni(CO)4]常温下为液态,易溶于CCl4、苯等有机溶剂。
① [Ni(CO)4]固态时属于________晶体(填晶体类型)。
②[Ni(CO)4]中Ni与CO的C原子形成配位键。不考虑空间构型,[Ni(CO)4]的结构可用示意图表示为_____________ (用“→”表示出配位键) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水是一种重要的氧化剂、漂白剂和消毒剂。它在NCP疫情控制中发挥重要作用。
(1)工业生产双氧水常采用催化剂—乙基蒽醌法,其反应过程如图所示:

写出工业制备H2O2(1)反应的热化学方程式___。
(2)过氧化氢还可以通过电解-水解法制得。工业上用Pt作电极材料,电解硫酸氢铵饱和溶液得到过二硫酸铵[(NH4)2S2O8],然后加入适量硫酸以水解过二硫酸铵即得到过氧化氢。写出阳极的电极反应式___;整个过程的总化学方程式是___。
(3)某课题组在298K时研究H2O2+2HI=2H2O+I2反应速率的影响因素,实验结果如下表:
试验编号 | 1 | 2 | 3 | 4 | 5 |
c(HI)/mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
c(H2O2)/mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
v/mol·L-1·s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 | 0.0228 |
分析上述数据,写出反应速率与物质浓度的关系式___;该反应的速率常数(k)的值为___。
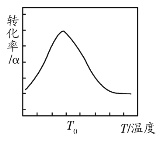
(4)过氧化氢是强氧化剂,在许多反应中有重要的应用。在一定温度下,将0.4molN2H4(g)和0.6molH2O2(g)装入2L固定容积的容器中,发生反应N2H4(g)+2H2O2(g)![]() N2(g)+4H2O(g) ΔH<0,当N2H4(g)的转化率为50%时反应达到平衡,该反应的化学平衡常数的值为___。
N2(g)+4H2O(g) ΔH<0,当N2H4(g)的转化率为50%时反应达到平衡,该反应的化学平衡常数的值为___。
实验测得反应中N2H4(g)的转化率(α)与温度(T)的关系如图所示,分析说明温度高于T0时,N2H4(g)的转化率下降的原因是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com